2.新乡医学院癌症研究中心;
3.三全医学院
2.Cancer Research Center, Xinxiang Medical University;
3.San Quan Medical College
贲门癌(gastric cardia adenocarcinoma, GCA)是 我国北方最常见的恶性肿瘤之一,其显著的流行 病学特征是与食管癌地域分布的一致性,在食管 癌高发区因上消化道梗阻为主要表现的肿瘤中, 食管癌约占60%,其余为贲门癌[1]。上世纪80年 代以前,贲门癌被归为食管癌。而西方国家,将 贲门癌归为食管胃交界部腺癌(Ⅱ型)[2, 3]。国内 外至今尚无贲门癌统一的临床病理分型标准,临 床上多借鉴食管或胃癌的TNM病理分期标准。目 前食管或胃癌的TNM分期以肿瘤的浸润程度、淋 巴结转移、远处器官转移三项指标划分肿瘤生长 扩张的严重程度。但肿瘤的扩张性生长不仅表现 在浸润程度、淋巴结转移、远处转移等指标上, 肿瘤最长直径也在一定程度上反映了肿瘤在平面 水平扩张性生长的特殊方式。近年的研究提示肿 瘤大小(直径)可能与肿瘤淋巴结转移和预后有 关,但因样本量较小等尚无一致认可的结论[4, 5]。 本研究旨在通过对4 826例贲门癌瘤体最长直径 (maximum tumor diameter,MTD)的测量,进一步 结合贲门癌生存期,阐明MTD与浸润程度、淋巴 结转移和分化程度的关系及其对贲门癌患者生存 和预后的影响。 1 资料与方法 1.1 研究对象
4 826例贲门癌患者来自河南省食管癌生物 样品信息资料库,均为1973—2012年间经病理确 诊为贲门腺癌并行贲门癌根治术的患者。其中 男3 741例(中位诊断年龄62岁,年龄范围22~87 岁),女1 085例(中位诊断年龄61岁,年龄范围 23~85岁),男女比值为3.5:1。 1.2 研究方法 1.2.1 肿瘤最长直径的测量
测量方法:将手术切除的贲门癌标本沿非肿 瘤侧剪开,平铺固定在平板上,充分完整地暴露 肿瘤,黏膜面朝上,用标尺测量肿瘤各曲度直 径,选肿瘤最长直径做为肿瘤长径。 1.2.2 问卷调查和生存随访
对4 826例贲门癌患者中1 756例家庭住址准 确、联系电话清楚的患者,采用入户问卷调查和 (或)电话随访记录患者的基本信息和生存状 况。随访时间从手术当日起,截至2012年12月8日。 1.3 统计学方法
所有数据采用SPSS 17.0进行统计学分析。计 数资料采用χ2检验;计量资料用秩和检验;关联性 分析用Spearman秩相关;生存率根据Kaplan-Meier 法计算,并用Log rank检验分析组间生存率的差 异;采用Cox比例风险回归模型对影响贲门癌患者 预后的多因素进行分析。检验水准:α<0.05。 2 结果 2.1 肿瘤长径、浸润程度和淋巴结转移、分化程 度的关系
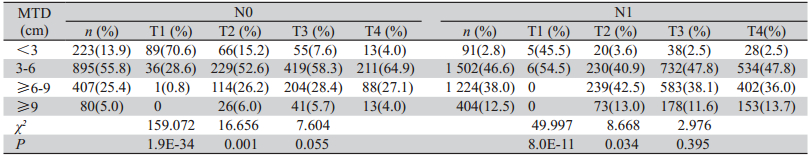
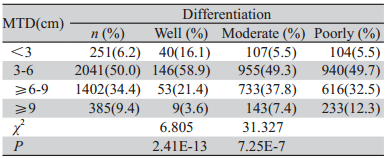
4 826例患者的MTD平均数和中位数分别 为(5.6±2.3cm)、5.0 cm(0.5~18.0 cm)。依MTD 长度,将贲门癌患者分为四组(MTD<3 cm、 3~6 cm、≥6~9cm、≥9 cm),随着MTD的增 长,患者淋巴结转移阳性率逐渐升高(r=0.254, P=4.0E-72),浸润程度也逐渐加深(r=0.102, P=1.2E-12)。4 079例分化程度明确的患者分 析发现,随着MTD增长,癌细胞分化程度变差 (r=0.069,P<0.05),见表1、2。
|
|
表1 贲门癌MTD与浸润程度、淋巴结转移的比较 Table 1 Comparison of MTD with infiltration and lymph node metastasis of GCA |
|
|
表2 贲门癌MTD与分化程度的比较 Table 2 Comparison of MTD with differentiation of GCA |
4 826例患者中家庭住址准确、联系电话清楚 的患者有1 756例,成功随访1 668例,随访率为 95%。该组患者的5年生存率为40%,中位生存期 为4.31年。Log rank检验显示:MTDɺ淋巴结转 移、浸润程度和分化程度等因素均明显影响食管 癌患者生存期。
随着MTD的增长,患者生存率明显下降 (P=3.3E-24),见图1。淋巴结转移阴性患者的 生存期随着MTD的增加逐渐下降,阳性患者与 之相同且预后更差(P=8.5E-5、P=1.4E-9),见 图2。随着浸润程度的增加,患者生存期也逐渐 下降,且患者的肿瘤浸润程度分别在T1~4的情况 下,随着MTD的增加,患者的生存率也逐渐下降 (P=0.036、P=1.3E-7、P=1.5E-4、P=2.7E-9), 见图3。分化程度较差的患者预后也明显较分化程 度好的患者差(P=1.4E-9),见图4。
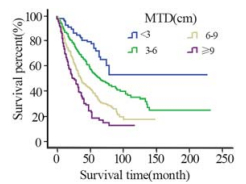 | 图1 贲门癌患者不同MTD的整体生存曲线 Fig.1 Overall survival curves of different MTD |
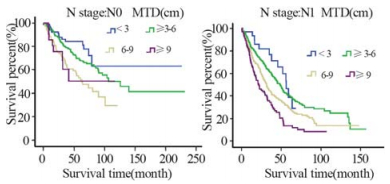 | 图2 贲门癌患者有无淋巴结转移不同MTD的整体生存曲线 Fig.2 Overall survival curves of GCA with different MTD in each N stage |
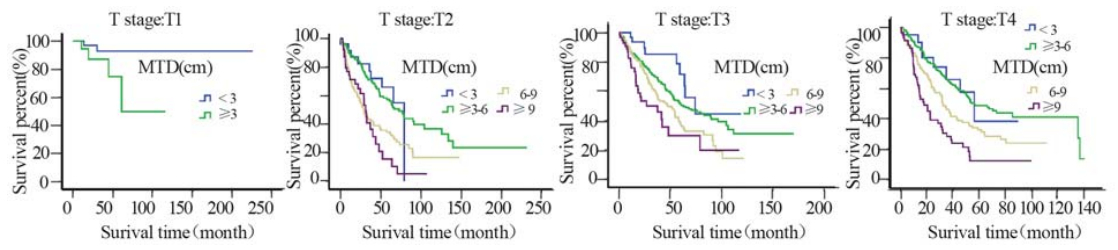 | 图3 贲门癌患者每层浸润程度不同MTD的整体生存曲线 Fig.3 Overall survival curves of GCA with different MTD in each T stage |
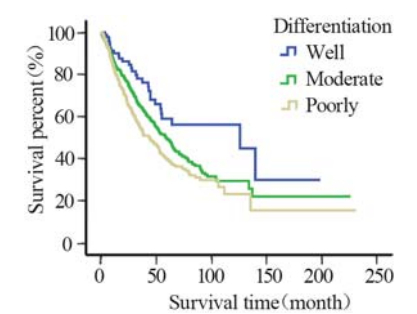 | 图4 贲门癌患者癌细胞高、中、低分化的整体生存曲线 Fig.4 Overall survival curves of GCA with well-, moderate-, and poorly-differentiation |
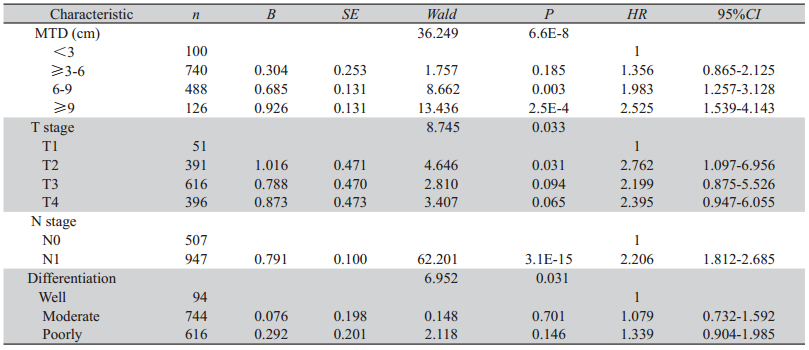
1 454例各项资料均齐全的病例,经Cox风险 回归模型分析,结果表明肿瘤长径、TNM分期和 分化程度是影响贲门癌患者预后的独立因素(P <0.05),见表3。MTD越长,患者生存期越差。
|
|
表3 贲门癌患者的病理多因素生存分析 Table 3 Multivariate analysis of pathology variables for the survival of patients with GCA |
近年已有多篇关于贲门癌MTD的研究报道[4, 5] , 提示MTD与贲门癌预后有关。但是,这些研究或 因样本量较小,或因随访时间较短,或因缺乏Cox 多因素分析,有关MTD与贲门癌生存关系,特别 是MTD与淋巴结转移、浸润程度和分化程度的关 系尚无明确的结论。
本研究发现:贲门癌瘤体最长径(MTD) 是贲门癌的独立生存影响因素,特别值得指出的 是,MTD也能够反映淋巴结转移阴性患者的生 存和预后。多因素Cox分析证明MTD、淋巴结转 移、瘤细胞浸润程度和分化程度是贲门癌患者独 立预后因素。这些结果进一步说明贲门癌瘤体最 长径是影响患者预后的重要因素之一。
本研究的第二个主要发现是:MTD与淋巴结 转移、瘤细胞浸润程度和分化程度密切相关。这 一结果进一步为贲门癌临床病理分期提供重要客 观指标。近年的研究已证明淋巴结转移、瘤细胞 浸润程度和分化程度与贲门癌患者生存和预后关 系十分密切[6, 7, 8]。但是,这三种重要病理变化指标 都依赖于贲门癌术后切除组织大标本的病理检立 查,对于非手术治疗的患者和淋巴结转移阴性患 者的预后评价受到局限。此外,淋巴结转移的阳 性检出率也受到许多人为因素的影响[9]。临床外 科医师的经验是获取可疑转移淋巴结的数量的重 要保证。在获取数十枚可疑淋巴结后,正确的临 床病理取材和组织学检查是发现转移淋巴结的又 一重要保证。很显然,临床病理检查发现转移淋 巴结是判断淋巴结转移的金标准,但是,由于外 科医师切除或清扫淋巴结的技术或经验的局限, 对病理检查未发现淋巴结转移的患者,并不能完 全排除患者已发生淋巴结转移的可能。瘤细胞 浸润程度和分化程度更多的受到临床病理取材的 影响。即使在一张病理切片中也可以观察到不同 区域存在不同的浸润深度和癌细胞不同的分化程 度。与此相反,瘤体最长径的测量能更客观的反 映肿瘤的生物学特性,方法简单,重复性极好, 人为判断影响因素轻微,特别是结合目前高精影 像学检查,术前即可得到比较明确的判断,并能 弥补淋巴结转移和瘤细胞浸润程度因需手术后判 断带来的不足,应作为贲门癌临床病理分期、判 断预后和治疗方式选择的重要指标之一。
临床病理分期是恶性肿瘤预后和治疗方式选 择的重要依据。根据瘤细胞浸润程度(T)淋巴结 转移(N)和远处器官转移(M)而确定的TNM 分期,即病理分期,已被广泛应用于临床对恶性 肿瘤的预后和治疗方式选择的重要标准。遗憾的 是,目前尚无贲门癌统一的TNM分期标准。由于 解剖部位的特殊性,特别是考虑到贲门癌与食管 癌高度的地域流行一致性和相似的临床症状,加 之上世纪80年代前,临床上把贲门癌归类为食管 癌[10],目前临床上仍采用食管癌或胃癌的TNM分 期标准对贲门癌进行病理分期。很显然,贲门癌 在组织起源上和生长方式及治疗措施上均不同于 食管癌,而在地域流行特征,主要危险因素等方 面,贲门癌又明显不同于胃癌 [1]。有学者提出贲门癌 是不同于食管癌和胃远端癌的一种独立的疾病 [1, 11]。 因此,制定贲门癌独特的病理分期标准是目前贲 门癌研究领域的重要研究课题之一。
本研究提示,淋巴结转移、瘤细胞浸润程度 和MTD是影响贲门癌的独立因素,据此,笔者提 出如下贲门癌临床病理TNM分期设想:贲门癌 TNM分期标准:贲门癌的T分级标准:Tis:黏膜 内癌;T1a:肿瘤侵及黏膜下层、MTD <3 cm, T1b:肿瘤侵及黏膜下层MTD≥3 cm;T2a:肿瘤 侵及肌层、MTD <6 cm,T2b:肿瘤侵及肌层、 MTD≥6 cm;T3a:肿瘤侵及贲门浆膜、MTD <6 cm,T3b:肿瘤侵及贲门浆膜、MTD 6~9 cm, T3c:肿瘤侵及贲门浆膜、MTD ≥9 cm;T4a: 肿瘤侵及邻近器官、MTD <6 cm,T4b:肿瘤侵 及邻近器官、MTD 6~9 cm,T4c:肿瘤侵及邻近 器官、MTD ≥9cm;贲门癌的N分级标准:N0: 无区域淋巴结转移N1:有区域淋巴结转移;贲门 癌的M分级标准:M0:无远处转移;M1:有远 处转移;贲门癌TNM肿瘤分级标准:0期:Tis N0 M0;Ⅰ期:T1a N0 M0;ⅡA期:T1b N0 M0, T2a N0 M0;ⅡB期:T2b N1 M0,T3a N0 M0, T3b N1 M0;Ⅲ期:T3c N1 M0,T4a N Any M0, T4b N Any M0,T4c N Any M0;Ⅳ期:T Any N Any M1;贲门癌临床分期:早期:0期和Ⅰ期;中 期:Ⅱ期和Ⅲ期;晚期:Ⅳ期。
综上所述,对贲门癌进行瘤体最长径测量, 并根据最长径数值将贲门癌分为4种类型可以反映 贲门癌生存和预后,特别是对淋巴结转移阴性患 者的预后评价。与淋巴结转移、瘤细胞浸润程度 和分化程度一样,MTD为贲门癌预后的独立影响 因素,与淋巴结转移、浸润程度和分化程度指标 相比,最长径测量更客观,并不受手术治疗的局 限和人为经验等因素的影响,测量简便,重复性 好,特别是结合高精影像检查,术前或非手术治 疗均可获得。据此,作者结合MTD提出贲门癌的 独立TNM病理分型建议标准,这一标准尚需更多 研究和临床实践证实。
| [1] | Wang LD, Zheng S.The mechanism of esophagus and gastric cardia change in Henan crowd with high incidence of esophageal cancer[J]. Zhengzhou Da Xue Xue Bao (Yi Xue Ban),2002,37(6):717-29.[王立东,郑树. 河南食管癌高发区人群食管和贲门癌变机制[J].郑州大学学报(医学版),2002,37(6):717-29.] |
| [2] | Siewert JR, Stein HJ.Classification of adenocarcinoma of the oesophagogastric junction[J]. Br J Surg,1998,85(11):1457-9. |
| [3] | Ichikura T,Chochi K,Sugasawa H,et al.Proposal for a new definition of true cardia carcinoma[J].J Surg Oncol,2007,95(7):561-6. |
| [4] | Fang DK,Wang LJ,Zhang DW,et al.Cardia maximum diameter grading and prognosis discussion[J].Zhonghua Zhong Liu Za Zhi,2000,22(2):161-3. [方德康, 汪良骏, 张大为, 等. 贲门癌最大径分级与预后的关系探讨[J]. 中华肿瘤杂志,2000,22(2):161-3.] |
| [5] | Xu Y, Zhu HY,Long ZW,et al.Prognosis analysis of adenocarcinoma of gastroesophageal junction[J].Zhongguo Ai Zheng Za Zhi,2010,20(6):446-51.[徐宇,朱蕙燕,龙子雯,等.食管胃结合部腺癌的预后分析[J].中国癌症杂志,2010,20(6):446-51.] |
| [6] | Liu W,Hao XS,Fan Q,et al.Cox proportional hazard model analysis of prognosis in patients with carcinoma of esophagus and gastric cardia after radical resection[J].Zhonghua Zhong Liu Za Zhi,2008,30(12):921-5.[刘巍, 郝希山, 范倩, 等. 行根治术治疗食管癌和贲门癌患者的预后分析[J].中华肿瘤杂志,2008,30(12):921-5.] |
| [7] | Zhang M, Li Z, Ma Y,et al.Prognostic predictors of patients with carcinoma of the gastric cardia[J]. Hepatogastroenterology,2012,59(115):930-3. |
| [8] | Zhang YF,Shi J,Yu HP,et al.Factors predicting survival in patients with proximal gastric carcinoma involving the esophagus[J]. World J Gastroenterol,2012,18(27):3602-9. |
| [9] | Huang CM,Lin JX,Zheng CH,et al.Prognostic impact of dissected lymph node count on patients with node-negative gastric cancer[J].World J Gastroenterol,2009,15(31):3926-30. |
| [10] | Chen ZF.Incidence and geographic of esophagus-gastric junction adenocarcinoma[J].Zhongguo Zhong Liu Lin Chuang,2011,38(1):57-60. [陈志峰.食管-胃交界腺癌地域发病特点与思考[J].中国肿瘤临床,2011,38(1):57-60.] |
| [11] | Deans C,Yeo MS,Soe MY,et al.Cancer of the gastric cardia is rising in incidence in an Asian population and is associated with adverse outcome[J].World J Surg,2011,35(3):617-24 |
 2014, Vol. 41
2014, Vol. 41