文章信息
- 汪永强,叶婷,刘靳波. 2014.
- WANG Yongqiang, YE Ting, LIU Jinbo. 2014.
- 抑癌基因甲基化谱分析在肝细胞癌诊断中的价值
- DNA Methylation Profile of Tumor Suppressor Genes in Diagnosis of Primary Hepatocellular Carcinoma
- 肿瘤防治研究, 2014, 41(12): 1330-1334
- Cancer Research on Prevention and Treatment, 2014, 41(12): 1330-1334
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.12.017
-
文章历史
- 收稿日期:2014-02-11
- 修回日期:2014-07-01
2.646000 泸州,四川省泸州医学院附属医院检验科
肝细胞癌(hepatocellular carcinoma,HCC) 病因复杂,其发生的分子机制目前尚不明确。启 动子CpG岛高甲基化是抑癌基因失活的重要机制 之一,在肿瘤的发生、发展过程中扮演着重要角 色。目前相关研究已经证实,许多抑癌基因在肿 瘤中的沉默由启动子区高甲基化改变所致[1]。DNA甲基化异常是肿瘤形成和发展的重要原因之一, 多基因甲基化频率的联合分析对于探索肿瘤分子 机制、筛选肿瘤生物标志物及探索肿瘤治疗新途 径具有重要意义。
基于此,本研究中应用MSP法,比较肝细胞癌 及癌旁组织的beclin 1、RASSFA-1、p16和DAPK 共4种抑癌基因的甲基化状态,并进一步联合AFP 分析以Logistic回归曲线拟合的ROC曲线,以探讨 肝细胞癌中DNA甲基化谱的临床诊断价值及肝细 胞癌发生的分子机制。
1 资料与方法 1.1 临床资料选取泸州医学院附属医院2007年3月—2010年 12月收治的HCC 患者37例,其中男31例,女6例, 平均年龄为52岁(29~73岁)。其中20例HCC患 者同时留取手术切除肿瘤标本及相应匹配非癌组 织(noncancerous tissue,NCT)(距离癌组织>3 cm),液氮速冻后于-80℃保存。患者在接受治疗 前采集肘静脉血5 ml,用乙二胺四乙酸钾抗凝,于 4℃下2 000 g 离心10 min,转移上清液,于4℃下 12 000 g 再次离心10 min,将上清液以600微升/管 分装后,置-80℃保存。同时收集健康志愿者外周 静脉血5 ml,用上述同样的方法处理与保存。所有 标本的采集均获得患者的知情同意及泸州医学院 附属医院伦理委员会批准。
1.2 主要试剂SYBR® Premix DimerEraserTM Kit购自日 本TaKaRa公司;TIANamp Genomic DNA Kit、 TIANamp Micro DNA Kit购自天根生化科技(北京)有限公司;热启动Taq酶购自德国Qiagen公 司;Wizard DNAClean-Up System购自美国Promega 公司;甲基化修饰试剂盒EZ DNA Methylation- Direct Kit购自美国Zymo公司,甲基化酶M.SssⅠ 为NEB公司产品;采用电化学发光免疫分析仪 Elecsys 2010检测患者血清AFP含量。 1.3 DNA甲基化检测体系建立
用TIANamp Genomic DNA Kit提取组织基因组 DNA,然后用NanoDrop ND-1000(美国NanoDrop 公司产品)对DNA 样品定量分析。基因组DNA 的亚硫酸氢盐处理:按ZYMO试剂盒说明书操 作,用亚硫氢酸盐法对基因组DNA的胞嘧啶进 行转化:取基因组DNA约1 000~1 500 ng,与CT 转化剂混匀后避光条件下进行温度变性:98℃ 10 min,64℃ 2.5 h。反应溶液经洗涤脱硫,用于下 一步PCR反应;PCR反应:参考文献设计beclin 1[2]、RASSFA-1[3]、p16[4]和DAPK[5]基因甲基化特 异性PCR引物,引物序列、退火温度及产物长度 见表 1。PCR反应体系25 μl,其中:PCR buffer (Mg2+):2.5 μl; dNTP: 2 μl; 引物各1 μl;热 启动Taq:0.15 μl;亚硫酸氢盐修饰后的DNA:5 μl;双蒸水补足至25 μl。反应条件:95℃预变性5 min,95℃变性30 s,退火50 s,72℃延伸30 s,共 35个循环,72℃延伸10 min。产物于2%琼脂糖凝 胶中电泳分离,溴化乙锭染色,凝胶成像系统扫 描观察。以目的条带与内参β-actin条带平均吸光度 比值作为判断标准。用Quantity one v4.62 软件分 析灰度值,计算相对量。
 |
应用SPSS16.0软件对数据进行统计分析,各组基因甲基化检出率(%)的比较采用χ2检验,构建 受试者工作特征(receiver operating characteristics, ROC)曲线,根据ROC曲线计算临界值并评估各甲 基化水平对HCC 的诊断价值,并进行逐步Logistic 回归,分析单一抑癌基因甲基化指标、联合抑癌基 因甲基化指标及与AFP联合分析对肝癌的诊断价 值。P<0.05 为差异有统计学意义。
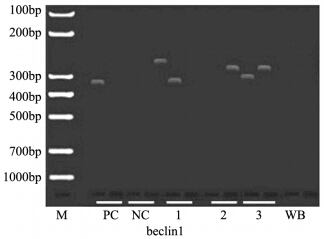
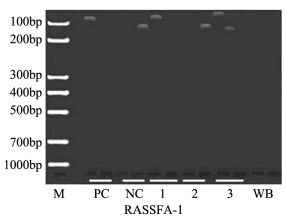
2 结果 2.1 肝细胞癌患者抑癌基因甲基化率应用MSP检测37例肝细胞癌及20例癌旁组 织beclin 1、RASSFA-1、p16 和DAPK肿瘤抑制 基因的甲基化率分别为5.4%、94.6%、73.0%和 35.1%,其甲基化条带见图 1~4。 HCC中4个肿瘤 抑制基因的异常甲基化由高到低分别为RASSFIA (94.6%)、p16(73.0%)、DAPK(35.1%)和 beclin 1(5.4%),RASSFA-1、p16和DAPK基因 在肝细胞癌组织中的甲基化率均明显高于相应的 癌旁组织(P<0.05),见表 2。
|
| M: marker; PC: positive control; NC: negative control; WB: water blank; 1-3: methylation-specific PCR and non methylation-specific PCR product; bp: base pair; MSP: methylation-specific PCR图 1 肝细胞癌组织中beclin 1基因的MSP产物 Figure 1 MSP products of beclin 1 in hepatocellular carcinoma(HCC) tissues |
|
| 图 2 肝细胞癌组织中RASSFA基因的MSP产物 Figure 2 MSP products of RASSFA in HCC tissues |

|
| 图 3 肝细胞癌组织中p16基因的MSP产物 Figure 3 MSP products of p16 in HCC tissues |

|
| 图 4 肝细胞癌组织中DAPK基因的MSP产物 Figure 4 MSP products of DAPK in HCC tissues |
 |
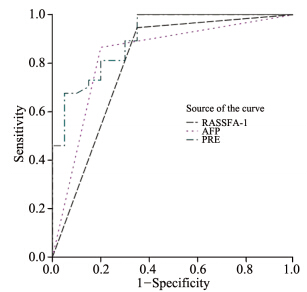
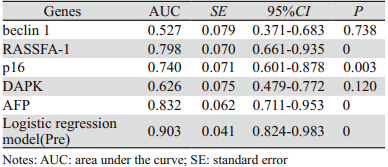
将AFP>3.6 mg/L为阳性界值,进行计数资料 转换,逐步Logistic回归法和模拟变量的ROC曲 线,运用软件逐步回归,beclin 1、p16和DAPK 被剔除,beclin 1、RASSFA-1、p16、DAPK和 AFP(转换后),Logistic回归曲线联合预测概率 (Pre)曲线下面积(area under the curve,AUC) 分别为0.527、0.798、0.740、0.626、0.832和 0.903,见图 5。其中beclin 1与DAPK的AUC显示差 异无统计学意义,见表 3。
|
| 图 5 逐步Logistic回归曲线联合肝细胞癌患者AFP和RASSFA-1概率预测的曲线下面积 Figure 5 AUC of predicted probability of stepwise Logistic regression curve combined with RASSFA-1 and AFP in HCC patients |
 |
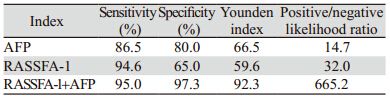
根据 ROC曲线和逐步Logistic回归,计算出各指标的敏感度、特异性、Youden指数(敏感度+特 异性-1)和阳性似然比/阴性似然比。联合分析: 以AFP为基本指标,在此基础上与RASSFA-1指标 联合分析,按任一指标超过“界值”即定为肝癌, AFP、 RASSFA-1的Youden指数、阳性似然比/阴 性似然比最高,并兼顾了较高的敏感度和特异性, 见表 4。
 |
以临床、病理学、生化、血清学和影像学信 息为基础的肿瘤现行分期和分型标准与十余年前 也无明显变化。近十余年的基因组学研究虽然提供了大量与肿瘤相关的遗传性和表达性(在 mRNA和蛋白质水平)谱式异化的信息,并极大 地提高了我们对肿瘤的认识。这与肿瘤的高度复 杂性、异质性和高适应性等原因相关外,与甲基 化的特征不无关联。DNA甲基化是一种表观遗传 修饰,它对维持染色体的结构、X染色体的失活、 基因印记和肿瘤的发生发展都起重要的作用[6]。它 与转录调节、染色体结构、外源DNA侵袭时细胞 的自我保护密切相关,也是肿瘤发生早期事件之 一。
肿瘤是一系统性疾病,癌旁组织很可能已有 癌发生前期、早期的遗传学和表观遗传学的异 常;推测基因所发生的启动子甲基化谱式的变化 很可能代表肝癌早期和晚期的变化。属于早期阶 段的基因有RASSF1A;而属于晚期阶段的基因为 pl6[7]。RASSF1A是被广泛研究的抑癌基因,参与 了肿瘤发生发展的全过程。p16基因的编码产物 P16蛋白是作用于细胞分裂周期的关键酶之一, 它直接作用于细胞周期抑制细胞增殖,如表达缺 失则致细胞永生化形成肿瘤。beclin 1是位于染色 体17q21的一种抑癌基因,Li等研究20例散发侵袭 性乳腺导管癌,发现45%的乳腺癌检获杂合性缺 失及5' 末端到内含子2密集的CpG岛。甲基化分析 显示,beclin 1启动子和内含子2异常甲基化,且 肿瘤beclin 1表达下降。由此提出一个假设:乳腺 癌中BRCA1和beclin 1 具有协同效应。此论点在 肝癌中的作用有待进一步证实[8]。DAPK基因所编 码的死亡相关蛋白激酶(death-associated protein kinase,DAPK)参与干扰素、Fas、肿瘤坏死因 子-α等多条凋亡途径。本实验发现,HCC中beclin 1、DAPK的甲基化率较低,但DAPK在癌旁组织 中亦有一定程度的甲基化且差异具有统计学意义 (P=0.04),提示HCC中,DAPK基因甲基化的 发生是一种早期且普遍存在的现象;对其甲基化 的检测,有可能成为早期发现肿瘤的一种有效手 段。在本研究中p16和RASSF1A基因高甲基化体现 出较高的诊断价值。
甲胎蛋白作为临床诊断肝原发性肝癌的一 项重要筛查指标,已广泛应用于临床实践[9]。 RASSF1A甲基化分析对于HCC的非侵入性诊断具 有重要价值,费伯健等[10]运用MRSE-qPCR方法检 测了45例肝组织中RASSF1A启动子中5个CpG位 点的甲基化状态,发现HCC组织的甲基化阳性率 显著高于癌旁组织,而正常肝组织中均为阴性; 再检测血浆标本的RASSF1A甲基化状态,证实 HCC患者血浆RASSF1A甲基化阳性率及程度均 显著高于肝良性病变患者和健康对照组。另外, 国内亦有一项小样本研究发现,HCC患者血清中RASSF1A甲基化阳性率为40%(14/35),10例健 康对照组均为阴性[11]。本研究将RASSF1A基因高 甲基化作为标志物,与beclin 1、P16、DAPK三 种甲基化基因和AFP这一常见的肿瘤标志物联合 应用,共同进行肿瘤早期诊断和预后评估。通过 SPSS13.0统计软件绘制ROC曲线,并比较四种抑癌 基因甲基化指标,同时按照AUC原则提供“界值”, 以保证最大限度地区别肝癌与癌旁组织。用逐步 Logistic回归拟合最佳曲线时,beclin 1、p16和DAPK 因不符合要求(P>0.1),预测价值相对较小,被剔 除。通过回归模型中的概率值来拟合ROC曲线。这 样得到的ROC曲线可以从几何意义上直观地反映 模型拟合情况,通过曲线下面积反映Logistic模型 的拟合效果,以此更好地对模型优度与实际资料 的符合情况进行评价。本文方程拟合的优度和预 测效果比较理想,其预测概率ROC曲线的AUC为 0.904。
联合分析的价值大小可用逐步Logistic回归分 析来衡量[12]。因单一beclin 1、p16和DAPK基因 甲基化对诊断肝癌诊断价值较小,未进入回归模 型,RASSF1A甲基化指标则进入Logistic回归模 型,同时验证AFP确实仍是本研究中有价值的诊 断指标,根据 ROC曲线和逐步Logistic回归,计 算出各指标的敏感度、特异性、Youden指数(敏感 度+特异性-1)和阳性似然比/阴性似然比。联合分 析:以AFP为基本指标,在此基础上与RASSFA-1 指标联合分析,AFP+RASSFA-1的Youden指数、 阳性似然比/阴性似然比最高,其中阳性似然比/阴 性似然比远远高出单一指标,可能是与我们获得 的病例较为局限,均来自于肝胆外科有关。本研 究诊断效果有待扩大确诊(病理学组织检查为标 准)或疑似患者人群后验证。至于它评价肝癌外 科治疗、化疗、放疗的效果、判断预后、肿瘤转 移情况以及能否单独用作疗效评估,还需作进一 步研究。国内已有实验通过甲基化特异性PCR分 析RASSFA-1甲基化状态,结果显示24例肝癌组 织中20例(83.3%)发生异常甲基化,相应的癌 旁组织中有9例(37.5%)发生;4株肝癌细胞株 都检测到了异常甲基化,而正常肝组织及正常肝 细胞株却未检测到异常甲基化;另外肝癌如合并 肝硬化(93.8%),低分化肝癌(92.9%)及周围 血管浸润和远处转移(91.7%)等,其启动区异 常甲基化明显高于无肝硬化(55.6%)、分化程 度较高(70.0%)及无周围血管浸润和远处转移 (66.7%)的肝癌[13]。因此,肝癌RASSFA-1基因 甲基化程度可作为用于判断肝癌恶性程度及预后 评估等的生物标志物。
总之,本研究通过检测HCC抑癌基因启动子 区异常甲基化,分析了四种基因甲基化与HCC发 生的可能关系。多基因甲基化和临床常见指标的 分析可能成为HCC新的敏感肿瘤分子标志物组 合,检测基因甲基化对HCC早期无创性诊断及判 断复发有一定的临床意义和价值。
| [1] | Das PM, Singal R. DNA methylation and cancer[J]. J Clin Oncol, 2004, 22: 4632-42. |
| [2] | Li Z, Chen B, Wu Y, et al. Genetic and epigenetic silencing of the beclin1 gene in sporadic breast tumors[J]. BMC Cancer, 2010, 10: 98. |
| [3] | Endoh H, Yatabe Y, Shimizu S, et al. RASSF1A gene inactivation in non-small cell lung cancer and its clinical implication[J]. Int J Cancer, 2003, 106(1): 45-51. |
| [4] | Abbaszadegan MR, Moaven O, Sima HR, et al. p16 promoter hypermethylation: a useful serum marker for early detection of gastric cancer[J]. World J Gastroenterol, 2008, 14(13): 2055-60. |
| [5] | Kato K, Iida S, Uetake H, et al. Methylated TMS1 and DAPK genes predict prognosis and response to chemotherapy in gastric cancer[J]. Int J Cancer, 2008, 122(3): 603-8. |
| [6] | Ni J, Chen HY, Cao N, et al. Effects of folate with different oxidative states on genomic DNA methylation in human lymphoblast cell line[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41(03): 256-9. [倪娟, 陈海燕, 曹能, 等. 不同氧化态叶酸对人成淋巴细胞系基因组DNA甲基化水平的影响[J]肿瘤防治研究, 2014, 41(03): 256-9.] |
| [7] | De Zhu J. The altered DNA methylation pattern and its implications in liver cancer[J]. Cell Res, 2005, 15(4): 272-80.. |
| [8] | Li Z, Chen B, Wu Y, et al. Genetic and epigenetic silencing of the Beclin1 gene in sporadic breast tumors[J]. BMC Cancer, 2010, 10: 98. |
| [9] | Zhang XF, Yin ZF, Wang K, et al. Changes of serum alphafetoprotein and alpha-fetoprotein-L3 after hepatectomy for hepatocellular carcinoma: prognostic significance[J]. Hepatobiliary Pancreat Dis Int, 2012, 11(6): 618-23. |
| [10] | Fei BJ, Huang ZH, Hua D, et al. Clinical significance of methylation of plasma Ras-association domain family 1A gene in the molecular diagnosis of hepatocellular carcinoma[J]. Zhong Liu, 2011, 31(8): 742-7.[费伯健, 黄朝晖, 华东, 等. 血浆Ras相关区域家族蛋白1A基因甲基化在肝细胞癌分子诊断中的价值[J]. 肿瘤, 2011, 31(8): 742-7.] |
| [11] | Qiu XQ, Chen G, Yu HP, et al. Detection of RASSF1A promoter hypermethylation in plasma of patients with primary hepatocellular carcinoma and its clinical significance[J]. Shi Jie Hua Ren Xiao Hua Za Zhi, 2009, 17(1): 90-3. [仇小强, 陈罡 ,余红平, 等. 肝癌患者血液RASSF1A基因甲基化的检测及其临床意义[J]. 世界华人消化杂志, 2009, 17(1): 90-3.] |
| [12] | Yu CH. SPSS and statistic analysis[M]. Beijing: Publishing House of Electronics Industry, 2007: 356-408. [宇传华. SPSS与统计分析[M]. 北京: 电子工业出版社, 2007: 356-408.] |
| [13] | Zhou XJ, Xue WJ, Qin L, et al. Epigenetic inactivation and clinical significance of tumor suppressor gene RASSF1A in hepatocellular carcinoma[J]. Jiangsu Yi Yao, 2007, 33(1): 24-7. [周晓俊, 薛万江, 秦磊, 等. 原发性肝癌中RASSF1A基因表达失活及其临床意义[J]. 江苏医药, 2007, 33(1): 24-7.] |
 2014, Vol. 41
2014, Vol. 41
