文章信息
- 韩晓娜,孙振强,唐勇,王海江,曲颜丽,汤旭山. 2014.
- HAN Xiaona, SUN Zhenqiang, TANG Yong, WANG Haijiang, QU Yanli, TANG Xushan. 2014.
- 结肠癌术前血浆纤维蛋白原水平与临床病理特征的关系
- Relationship Between Preoperative Fibrinogen Level and Clinicopathological Characteristics of Colon Cancer
- 肿瘤防治研究, 2014, 41(12): 1326-1329
- Cancer Research on Prevention and Treatment, 2014, 41(12): 1326-1329
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.12.016
-
文章历史
- 收稿日期:2013-10-31
- 修回日期:2014-03-26
近年来,随着人们生活水平的提高,胃肠道 肿瘤的发生也有上升趋势[1],结肠癌是人类消化 道常见的恶性肿瘤,早期发现和诊治结肠癌是提 高预后生存的关键,使人们对非侵入性检测指标产生了兴趣,尤其是简单方便的血浆中指标的检 测。纤维蛋白原是凝血过程的主要蛋白,对多种 疾病有临床意义,已经有研究发现纤维蛋白原的 升高与宫颈癌、卵巢癌、子宫内膜癌、肺癌进展 关系密切,并指出血浆纤维蛋白原是影响恶性肿 瘤预后的独立危险因素[2, 3, 4, 5, 6]。然而,作为一种炎性 反应程度指标,纤维蛋白原与恶性肿瘤临床病理 资料的关系,尤其在可行根治术的结肠癌[7]患者中 研究报道较少,本研究对此进行了探讨。
1 资料与方法 1.1 一般资料选取新疆医科大学附属肿瘤医院2005年6月— 2008年6月收治的接受根治术治疗的结肠癌患者 255例,其中男135例,女120例,年龄23~89岁, 平均(59.47±12.63)岁。所有患者均为术前未行 放化疗或免疫治疗、术后经病理证实的初诊者, 均接受根治术,包括右半结肠根治术、左半结肠 根治术、横结肠根治术。排除标准:8周之内使用 过促凝或抗凝药物者,合并肝炎、肾病、心梗、 高血压及其他感染性、血液性疾病者等可能影响 炎性反应指标的其他疾病。 1.2 测定方法
严格按照检验操作,采集患者静脉血置于 枸橼酸钠抗凝管(血凝专用)中混匀(9∶1比 例),离心取血浆,采用日本Sysmex CA-550全自 动血凝仪测定纤维蛋白原水平。 1.3 统计学方法
采用SPSS17.0统计软件进行数据分析,术前 纤维蛋白原与临床病理特征的单因素分析采用t检 验或单方向方差分析进行组间分析;以纤维蛋白 原2.81 g/L为截点,将纤维蛋白原量变为二分类变 量,多因素分析采用Logistic回归进行分析,P≤ 0.05为差异具有统计学意义。
2 结果 2.1 结肠癌术前纤维蛋白原与临床病理特征单因素分析结果255例结肠癌患者的术前平均纤维蛋白原为 (3.17±0.88)g/L,年龄、吸烟、肿瘤大小、肿 瘤位置、TNM分期、格拉斯哥预后评分(modify glasgow prognostic score,mGPS)、白细胞计 数、中性粒细胞计数/淋巴细胞计数(neutrophil/ lymphocyte ratio,NLR)、血小板计数/淋巴细胞 计数(platelet/lymphocyte ratio,PLR)及CEA均 与纤维蛋白原具有相关性,差异具有统计学意义 (P<0.05);而民族、肿瘤分级、BMI、肿瘤大体 类型、神经/淋巴管浸润、AFP均与纤维蛋白原无 相关性(P>0.05),详见表 1。
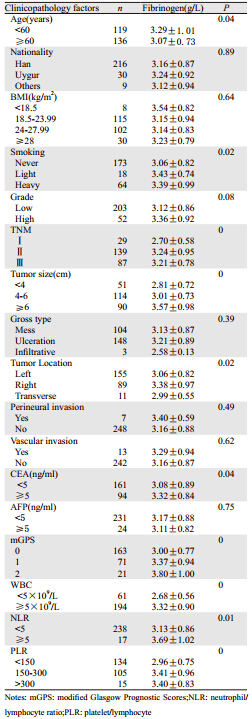 |
将上述单因素分析具有统计学意义的因素均 纳入多因素Logistic统计学分析中,以纤维蛋白 原2.81 g/L为截点分析,结果显示:白细胞计数 (RR=4.08,95.0%CI:2.07~8.04,P=0.00)、PLR (RR=1.79,95.0%CI:1.02~3.14,P=0.04)均与纤维 蛋白原具有相关性,差异有统计学意义,详见表 2。
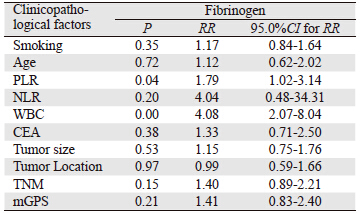 |
近些年来,恶性肿瘤与炎症系统的关系已逐 渐受到重视,成为热点研究问题[8],虽然人们认 识到恶性肿瘤的发生系基因水平的疾病,但越来 越多的证据表明,宿主的炎性反应在恶性肿瘤的 发展中起着重要的作用[9, 10]。与恶性肿瘤相关的 炎性细胞分泌的炎性介质及细胞因子,可以促进 肿瘤细胞的增殖、侵袭或转移,从而对患者的预 后产生影响,这些炎性指标包括以C-反应蛋白 (C-reactive protein,CRP)为基础的mGPS[11, 12]、 白细胞计数、NLR[13, 14]、PLR[11, 15]、纤维蛋白原[16] 等,尤其是纤维蛋白原,在血浆中容易检测,成 为人们研究的热点。
纤维蛋白原是肝脏合成的350 kDa的大分子蛋 白质,在凝血途径、血栓形成、创伤愈合及血小 板聚合中充当重要的角色,作为一种细胞外基质 蛋白,可能会通过纤维蛋白原-蛋白或蛋白细胞相 互作用影响细胞的行为。有研究[17]把纤维蛋白原 与肿瘤生长和转移潜能联系起来,其可能原因如 下:首先,肿瘤细胞中,基质细胞和炎性细胞发 现纤维蛋白原多重整合和非整合素受体,特定的 受体介导的纤维蛋白原与细胞的相互作用可抑制 细胞增殖、迁移、凋亡、信号分子和炎性介质的 表达;其次,已知的生长因子FGF和VEGF等纤维 蛋白原结合刺激血管生成,从而调节内皮细胞的 增殖和血管生成[17, 18],在新生血管的形成中起着重要的作用[19],而纤维蛋白原为起源的纤溶系统对 血管的生成以及肿瘤细胞的扩散也起到了促进的 作用[20]。它可以通过加强肿瘤细胞和血小板或内 皮细胞的黏附作用促进肿瘤的血液转移[21]。纤维 蛋白原缺陷小鼠的肺癌模型也证明纤维蛋白原是 循环肿瘤细胞转移潜能的一个重要决定因素[22]。 它还可以阻碍自然杀伤细胞介导的消除肿瘤细胞 的作用,提高其转移潜能[23]。这都表明了纤维蛋 白原参与了肿瘤细胞的侵袭、转移过程。
以上提示了纤维蛋白原最终影响了恶性肿瘤 患者的预后,正如Polterauer等[2]得出血浆纤维蛋 白原表达量与5年无进展生存期及5年总生存期均 密切相关(P<0.05),治疗前血清纤维蛋白量为 宫颈癌术后的独立影响因素,此研究团队同年对 卵巢癌同样术前行血清纤维蛋白量检测,并进行 生存分析,得出同样结论[3]。然而,影响预后的纤 维蛋白原与其他临床病理特征是否存在着联系, 也同样受到重点关注,有部分研究证实了治疗前 纤维蛋白原与不同恶性肿瘤的临床病理特征密切 相关。如Takeuchi等[24]研究显示纤维蛋白原与肿 瘤浸润深度、肿瘤大小、白细胞数、血小板数都 有相关性,同时高水平的纤维蛋白原量与淋巴结 转移、远处转移有关,而Ghezzi等[4]研究还显示了 纤维蛋白原与年龄、BMI具有相关性。在本研究 中,纳入的临床病理因素更多,结肠癌患者的术 前纤维蛋白原与肿瘤大小、TNM分期、mGPS评 分、白细胞计数、NLR、及CEA均有相关性,与 以上研究结论基本一致,本研究还发现白细胞计 数和PLR为影响纤维蛋白原的独立危险因素。此 外,在纤维蛋白原、吸烟与死亡率的关系研究[25] 中,显示了吸烟患者的纤维蛋白原水平高于非吸 烟患者。我们对于吸烟因素的分析也显示了两者 的相关性,但具体机制尚需进一步研究。
结肠癌患者纤维蛋白原水平升高的原因可能 与肿瘤生长对组织的损伤及引起炎性反应有关[26], 可能是肿瘤的生长引起高凝状态和低氧状态[27]或 由肿瘤细胞本身的生产[18],或通过在介导炎性细 胞如上皮细胞作为宿主抗肿瘤反应[28]。纤维蛋白 原浓度升高的主要来源虽然没有确定,但一些研 究者已经提出了术前纤维蛋白原水平的升高归咎 于宿主对抗癌症的全身炎性反应[29]。也就为本研 究及其他研究结果中纤维蛋白原量与其他炎性介 质的关系作了解释,肿瘤的进展是一个肿瘤细胞 和宿主相互作用的过程,不仅取决于肿瘤细胞的 本身特性,还决定于它所在的环境[30]。人们普遍 认识到肿瘤与炎性系统关系密切,肿瘤不仅可以 发生在如肝炎病毒或幽门螺旋杆菌感染的炎性部 位,也可以触发释放促炎细胞因子引起周围区域的炎性反应,形成炎性微环境[31, 32]。炎性微环境 在肿瘤的增殖和恶性细胞的生存中起着重要的作 用。本研究显示,血清纤维蛋白原与部分高水平 的炎性介质呈现相关性,如mGPS评分、白细胞计 数、NLR及PLR,与上述理论结果保持一致。
总之,通过本研究得知,血清纤维蛋白原与 结直肠癌某些临床病理特征具有密切相关性,为 降低血清纤维蛋白原、降低炎性微环境提供了可 能性。而目前相似的研究报道较少,有待于大样 本、多中心的进一步研究来证实。
| [1] | Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002[J].CA Cancer J Clin, 2005, 55(2): 74-108. |
| [2] | Polterauer S, Seebacher V, Hefler-Frischmuth K, et al. Fibrinogen plasma levels are an independent prognostic parameter in patients with cervical cancer[J]. Am J Obstet Gynecol, 2009, 200(6): 647, e1-7. |
| [3] | Polterauer S, Grimm C, Seebacher V, et al. Plasma fibrinogen levels and prognosis in patients with ovarian cancer: a multicenter study[J]. Oncologist, 2009, 14(10): 979-85. |
| [4] | Ghezzi F, Cromi A, Siesto G, et al. Prognostic significance of preoperative plasma fibrinogen in endometrial cancer[J]. Gynecol Oncol, 2010, 119(2): 309-13. |
| [5] | Zhao J, Zhao M, Jin B, et al. Tumor response and survival in patients with advanced non-small-cell lung cancer: the predictive value of chemotherapy-induced changes in fibrinogen[J]. BMC Cancer, 2012, 12: 330. |
| [6] | Zhu JF, Cai L, Zhang XW, et al. High plasma fibrinogen concentration and platelet count unfavorably impact survival in non-small cell lung cancer patients with brain metastases[J]. Chin J Cancer, 2014, 33(2): 96-104. |
| [7] | Song HJ, Park JW, Chang HJ, et al. Preoperative plasma hyperfibrinogenemia is predictive of poor prognosis in patients with nonmetastatic colon cancer[J]. Ann Surg Oncol, 2013, 20(9): 2908-13. |
| [8] | Coussens LM, Werb Z. Inflammation and cancer[J]. Nature, 2002, 420(6917): 860-7. |
| [9] | McDonald B, Spicer J, Giannais B, et al. Systemic inflammation increases cancer cell adhesion to hepatic sinusoids by neutrophil mediated mechanisms[J]. Int J Cancer, 2009, 125 (6): 1298-305. |
| [10] | Tenesa A, Theodoratou E, Din FV, et al. Ten common genetic variants associated with colorectal cancer risk are not associated with survival after diagnosis[J]. Clin Cancer Res 2010, 16(14): 3754-9. |
| [11] | Brown DJ, Milroy R, Preston T, et al. The relationship between an inflammation based prognostic score (GPS) and changes in serum biochemical variables in patients with advanced lung and gastrointestinal cancer[J]. J Clin Pathol, 2007, 60(6): 705-8. |
| [12] | McMillan DC. Systemic inflammation, nutritional status and survival in patients with cancer[J]. Curr Opin Clin Nutr Metab Care, 2009, 12(3): 223-6. |
| [13] | Walsh SR,Cook EJ, Goulder F, et al. Neutrophil-lymphocyte ratio as a prognostic factor in colorectal cancer[J]. J Surg Oncol, 2005, 91(3): 181-4. |
| [14] | Garcea G, Ladwa N, Neal CP, et al. Preoperative neutrophilto- lymphocyte ratio (nlr) is associated with reduced diseasefree survival following curative resection of pancreatic adenocarcinoma[J]. World J Surg, 2011, 35(4): 868-72. |
| [15] | Roxburgh CS, McMillan DC. Role of systemic inflammatory response in predicting survival in patients with primary operable cancer[J]. Future Oncol, 2010, 6(1): 149-63. |
| [16] | Seebacher V, Polterauer S, Grimm C, et al. The prognostic value of plasma fibrinogen levels in patients with endometrial cancer: a multi-centre trial[J]. Br J Cancer, 2010, 102(6): 952-6. |
| [17] | Simpson-Haidaris PJ, Rybarczyk B. Tumors and fibrinogen. The role of fibrinogen as an extracellular matrix protein[J]. Ann NY Acad Sci, 2001, 936: 406-25. |
| [18] | Sahni A, Simpson-Haidaris PJ, Sahni SK, et al. Fibrinogen synthesized by cancer cells augments the proliferative effect of fibroblast growth factor-2(FGF-2)[J]. J Thromb Haemost, 2008, 6(1): 176-83. |
| [19] | Fitzgerald DJ. Fibrinogen receptor and platelet signaling[J]. Blood Coagul Fibrinolysis, 1999, 10 Suppl 1: S77-9. |
| [20] | Gerner C, Steinkellner W, Holzmann K, et al. Elevated plasma levels of crosslinked fibrinogen g-chain dimmer indicate cancerrelated fibrin deposition and fibrinolysis[J]. Thromb Haemost, 2001, 85(3): 494-501. |
| [21] | Palumbo JS, Kombrinck KW, Drew AF, et al. Fibrinogen is an important determinant of the metastatic potential of circulating tumor cells[J]. Blood, 2000, 96(10): 3302-9. |
| [22] | Palumbo JS, Talmage KE, Massari JV, et al. Platelets and fibrin- (ogen) increase metastatic potential by impeding natural killer cell-mediated elimination of tumor cells[J]. Blood, 2005, 105(1): 178-85. |
| [23] | Palumbo JS, Talmage KE, Massari JV, et al. Tumor cell-associated tissue factor and circulating hemostatic factors cooperate to increase metastatic potential through natural killer cell-dependent and-independent mechanisms[J]. Blood, 2007, 110(1): 133-41. |
| [24] | Takeuchi H, Ikeuchi S, Kitagawa Y, et al. Pretreatment plasma fibrinogen level correlates with tumor progression and metastasis in patients with squamous cell carcinoma of the esophagus[J]. J Gastroenterol Hepatol, 2007, 22(12): 2222-7. |
| [25] | Everett CJ, Wells BJ, Frithsen IL, et al. Smoking, fibrinogen and cancer mortality[J]. J Natl Med Assoc, 2007, 99(4): 328-33. |
| [26] | Beer JH, Haeberli A, Vogt A, et al. Coagulation markers predict survival in cancer patients[J]. Thromb Haemost, 2002, 88(5): 745-9. |
| [27] | Palumbo JS, Kombrinck KW, Drew AF, et al. Fibrinogen is an important determinant of the metastatic potential of circulating tumor cells[J]. Blood, 2000, 96(10): 3302-9. |
| [28] | Lawrence SO, Simpson-Haidaris PJ. Regulated de novo biosynthesis of fibrinogen in extrahepatic epithelial cells in response to in flammation[J]. Thromb Haemost, 2004, 92(2): 234-43. |
| [29] | Roxburgh CS, McMillan DC. Role of systemic in flammatory response in predicting survival in patients with primary operable cancer[J]. Future Oncol, 2010, 6(1): 149-63. |
| [30] | Balkwill F, Mantovani A. Inflammation and cancer: back to Virchow?[J] Lancet, 2001, 357(9255): 539-45. |
| [31] | Mantovani A, Allavena P, Sica A, et al. Cancer-related inflammation[J]. Nature, 2008, 454(7203): 436-44. |
| [32] | Grivennikov SI, Greten FR, Karin M. Immunity, inflammation, and cancer[J]. Cell, 2010, 140(6): 883-99. |
 2014, Vol. 41
2014, Vol. 41


