文章信息
- 郭天兴,潘小杰,欧德彬,叶明凡. 2014.
- GUO Tianxing, PAN Xiaojie, OU Debin, YE Mingfan. 2014.
- 表现为磨玻璃样病变的肺腺癌临床特点与EGFR及K-RAS基因突变的关系
- Relationship of Clinical Characteristics and EGFR, K-RAS Mutation in Lung Adenocarcinoma Patients with Predominant Ground-glass Opacity
- 肿瘤防治研究, 2014, 41(12): 1313-1317
- Cancer Research on Prevention and Treatment, 2014, 41 (12): 1313-1317
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.12.013
-
文章历史
- 收稿日期:2014-06-04
- 修回日期:2014-08-19
肺磨玻璃样病变(ground-glass opacity,GGO)是指在CT影像上表现为密度增加,呈局灶云雾状密度的阴影,但阴影内血管和支气管纹理仍然清晰可辨。虽然是非特异性的CT征象,但部分早期肺腺癌特别是原位腺癌(adenocarcinoma in situ,AIS)在CT征象上主要表现为GGO[1,2,3],随着螺旋CT诊疗技术的发展,近年肺GGO的检出率有了明显提高,其临床价值日益受到重视。
表皮生长因子受体(epidermal growth factor receptor,EGFR)信号转导的异常是导致多种肿瘤发生的原因,目前以吉非替尼(Gefitinib)和厄洛替尼(Erlotinib)为代表的EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)作为非小细胞肺癌(NSCLC)的靶向治疗已广泛应用于临床,并成为NCCN指南推荐的标准治疗。EGFR-TKIs可通过与ATP竞争结合EGFR酪氨酸激酶域的ATP结合位点而抑制EGFR的活性,从而抑制EGFR下游多条信号通路的活化,从而达到抗肿瘤的作用。突变主要发生在外显子18-21,并以外显子19的缺失突变和外显子21 L858R的点突变为主。研究发现EGFR-TKI药物的应答性与EGFR基因突变密切相关,在突变型人群的治疗有效率可达50%~70%,特别是部分腺癌患者对吉非替尼的应答率较好,而在野生型人群有效率不足20%[4,5]。
RAS通路是调节EGFR活化下游效应的主要信号转导通路之一,K-RAS是该通路的重要调控基因,大约有80%的K-RAS基因突变发生于12号密码子上[6]。其突变可以引起EGFR非依赖性持续性激活,进而导致EGFR-TKIs原发性耐药,研究显示K-RAS基因突变多发生于应用EGFR-TKIs治疗过程中疾病进展的患者[7],是提示预后不良的分子标志[8]。目前国内对表现为GGO的肺腺癌病例分子靶向治疗专题研究尚较少,本研究通过检测表现为GGO病变的肺腺癌病例EGFR和K-RAS基因突变情况,并探讨了GGO病例的临床特点与EGFR和K-RAS基因突变的关系。1 资料与方法1.1 临床资料
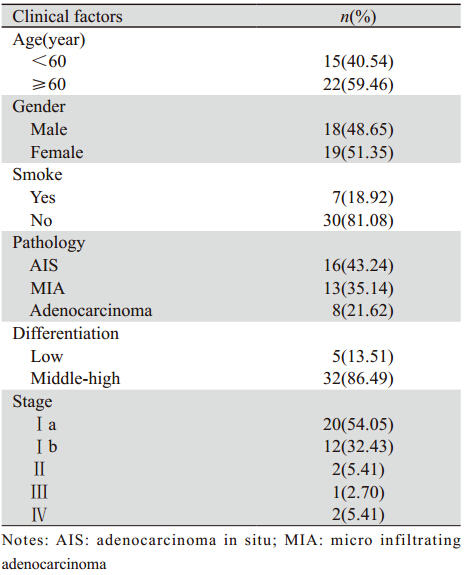
回顾性选择2011年1月—2013年6月接受手术治疗的、表现为GGO征象的肺腺癌患者37例,临床资料见表 1,男性18例,女性19例,年龄(62.24±1.79)岁,病程(293.30±120.36)天。右上肺13例,右中肺4例,右下肺6例,左上肺6例,左下肺8例。
 |
入组标准:(1)必须接受外科手术后经病理证实为腺癌者,手术方式为胸腔镜微创手术;(2)术前2周内均接受64层螺旋CT检查,肿瘤大小<3 cm;(3)GGO成分占结节大小>50%;(4)术前未接受放化疗;(5)无合并其他原发性恶性肿瘤。术后分期遵照2009年国际抗癌联盟(Union for International Cancer Control,UICC)第9版TNM分期标准。1.2 方法1.2.1 CT检查方法
所有入组病例术前2周内均接受64层螺旋CT(德国西门子Somatom sensation)增强扫描检查,CT扫描参数为:扫描范围从肺尖至肺底,扫描参数:准直器0.6 mm、Pitch=1.0、FOV=300 mm、电压=120 kV、电流采用自动毫安技术。增强扫描采用MEDRAD高压注射器(美国MEDRAD Avanta),自肘静脉注入非离子型造影剂90 mL(17.5 g),速度2.5~3 ml/s。在CT图像上观察GGO病变的部位、大小(最大径线)、形态,以及有无分叶、毛刺、空泡、空洞、空气支气管征象及胸膜牵拉征象。按CT征象上是否含有实性组织成分将GGO分为单纯型GGO(pure GGO,pGGO)和混合型GGO(mixed GGO,mGGO),将影像学表现与病理镜下所见进行对照分析。1.2.2 手术方法
所有入组病例均为胸腔镜手术。切口选择:观察孔选择在腋中线第7肋间;主操作孔在第4或第5肋间腋前线,长3 cm;辅助操作孔在肩胛下角线第7或8肋间。手术操作:首先明确肺病变区域并行楔形切除,送冰冻快速病理,证实为恶性则继续完成标准的肺叶切除术,主要特点有:(1)解剖性肺叶切除,即解剖肺门及叶裂内的血管和支气管,强调打开血管鞘游离肺动脉;(2)无固定模式切除血管和支气管,如遇动脉分支较多,处理较为困难时,可先处理支气管,然后再处理动脉各分支;(3)所有操作均在完全胸腔镜下完成。切除的肺叶置入标本袋中于主操作切口取出,防止污染切口,最后系统性清扫纵隔淋巴结。1.2.3 病理及突变检测
肿瘤新鲜组织自术中切除后留取部分标本后放入液氮中冷冻保存,石蜡标本以10%福尔马林固定,常规石蜡包埋,制备组织切片并行HE染色,并由2名病理医师分别阅片后明确病理类型。标本处理完毕送厦门艾德生物医药科技有限公司进行检测,EGFR基因18-21外显子突变及K-RAS基因12密码子突变检测采用实时荧光定量PCR法,按操作说明书进行。1.3 统计学方法
应用SPSS 19.0软件进行统计学分析,计数资料采用卡方检验,P<0.05为差异有统计学意义。2 结果2.1 CT检查结果
(1)部位:GGO病灶位于右上肺13例,右中肺4例,右下肺6例,左上肺6例,左下肺8例。(2)大小:全部病例病灶最大径线为2.5 cm,径线最小为0.4 cm。(3)密度:16例为均匀的磨玻璃影像,支气管-血管束走行于其中,为pGGO;21例密度不均匀,内见实性成份,为mGGO,在纵隔窗可见斑片状软组织密度影。(3)形态:GGO病灶边缘均毛糙,但与正常肺组织边界较清晰。其中21例见毛刺,17例位于胸膜下者见胸膜牵拉征象,11例病灶内见“空泡征”,6例病灶内见“空气支气管征”。2.2 手术结果
入组37例均接受胸腔镜手术治疗,无中转开胸,胸腔镜下探查26例先行楔形切除,冰冻快速病理明确恶性后再行肺叶切除,8例因不能明确病变结节定位而直接行肺叶切除术(均包括纵隔淋巴结清扫);另有术前证实1例因对侧纵隔淋巴结转移、2例因远处骨转移,手术仅以楔形切除明确病理类型。全组病例术后恢复顺利,术后病理显示,16例为AIS,13例为微浸润腺癌(micro infiltrating adenocarcinoma,MIA),8例为腺癌。2.3 EGFR及K-RAS基因突变检测结果
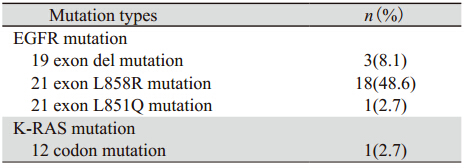
全部病例中EGFR基因发生突变22例,其中19外显子del突变3例;21外显子发生L858R突变18例,L851Q突变1例,均为点突变。K-RAS基因仅有1例发生突变,见表 2。
 |
分析pGGO与mGGO的基因突变情况,两组EGFR基因发生突变者各有10例及11例,差异无统计学意义(P>0.05);而仅有的1例K-RAS基因突变发生在mGGO组,比较差异无统计学意义(P>0.05),见表 3。
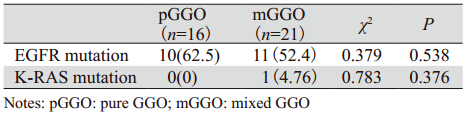 |
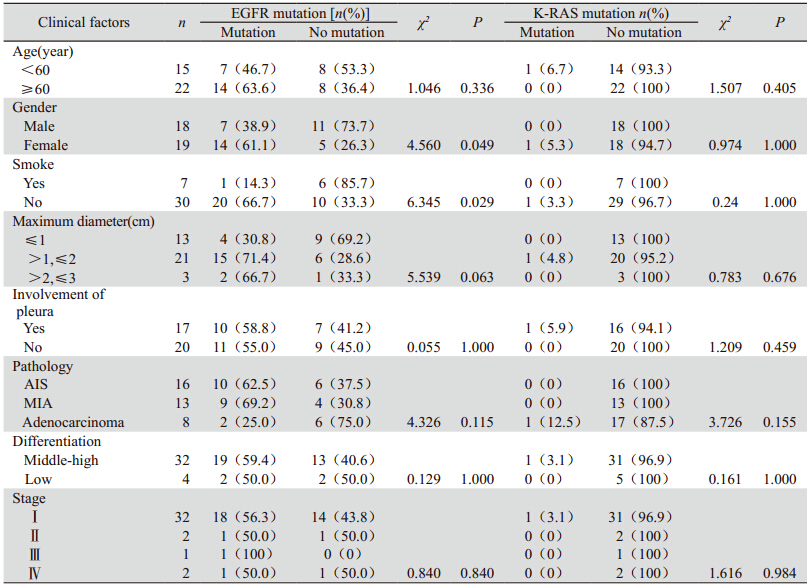
分析年龄、性别、吸烟、最大径线、累及胸膜、病理类型、分化、分期等临床因素与EGFR、K-RAS基因突变的关系,其中女性、无吸烟者与EGFR基因突变呈显著相关(P<0.05),而各临床因素与K-RAS基因突变无明显相关,见表 4。
 |
目前肺腺癌发病率呈不断升高趋势,其中部分肺腺癌在CT征象上主要表现为GGO,随着近年来螺旋CT技术的高速发展,GGO的诊断率有了大幅提高,作为CT征象上的特殊表现,目前认为GGO与肺腺癌密切相关,并不断在术后病理中得到证实[9,10]。
根据CT征象上GGO影像特点以及是否含有实性成分,可将GGO分成pGGO和mGGO,实质上反映了GGO的病理发展过程。初期病变组织沿肺泡壁伏壁生长,肺泡间隔增厚,肺泡腔未完全闭塞,含气比较充分,此为pGGO,此阶段的病理性质多为AIS或非典型腺瘤样增生(atypical adenomatous hyperplasia,AHA),即浸润前病变。随着病变浸润性生长,成纤维细胞增生,肺泡结构塌陷,病灶逐步演变为含实性成分的结节,即mGGO。如果病变继续发展,则累及脏层胸膜、侵犯周边组织血管,病理则多为AIS或MIA,此阶段则表现多种肺癌典型的征象,如毛刺征、分叶征、胸膜牵拉征等。
表现为GGO的肺腺癌生长较为缓慢,不同成分的GGO体积倍增时间为759~1 832天,提示预后较好[11],本研究中部分病例观察期较长,1例7年,1例达6年,1例达3年,且术后分期均局限在Ⅰ期,其中Ⅰa期1例,Ⅰb期2例;但因全组仍有5例病例出现淋巴结及远处转移,其中2例为肺门淋巴结转移,1例为对侧纵隔淋巴结转移,2例为骨转移,因此虽然可以考虑选择随访观察,仍应当警示发生远处转移的风险。
目前国内对表现为GGO的肺腺癌病例分子靶向治疗专题研究尚较少,在现有的研究中,EGFR和K-RAS基因突变已经成为能在肺癌的分子水平产生影响的生物分子标志,并影响肿瘤的生物学行为。因此研究GGO病例CT形态学及临床因素与EGFR、K-RAS基因突变之间的关系,为探索GGO病例的临床诊疗方向提供积极意义。在pGGO和mGGO的发展过程中,两组EGFR及K-RAS基因突变均未表现出显著差异(χ2=0.379,P=0.538;χ2=0.783,P=0.376),可以认为pGGO、mGGO是同一种疾病的不同发展阶段在CT征象上的不同反映,体现为形态学的不同,在分子水平上并没有发生根本的改变。本文中EGFR基因突变主要表现为外显子19缺失突变和外显子21 L858R点突变,另有1例为外显子21 L851Q点突变;仅有的1例K-RAS基因突变为12密码子突变,基本与现有研究结果相符。在全组病例,EGFR基因突变与年龄、最大径线、累及胸膜、病理类型、分化、分期等差异均未有统计学意义(p>0.05),而在女性、不吸烟患者中差异却有统计学意义,此与我们既往所认识的EGFR-TKIs药物,尤其是吉非替尼在东方女性、不吸烟肺腺癌患者中应答率较高的结论相印证[12]。而K-RAS基因突变与上述临床因素均无显著相关,但可能与其突变率较低的原因有关。研究显示[13,14]K-RAS基因突变多发生于应用EGFR-TKIs治疗过程中疾病进展的NSCLC患者,K-RAS基因突变可能是预测对EGFR TKIs原发耐药的分子标记之一。
EGFR基因突变病例在表现为GGO的肺腺癌病例表现出较高的突变率,达56.8%(21/37),为以后可能需要的分子靶向治疗提供了明朗的信息,并对优化临床诊疗模式作了有意义的探索。K-RAS基因突变率较低,有报道认为在亚洲人群低于欧洲人群,可以在大样本研究中进一步探索临床意义。
| [1] | Lee SW, Leem CS, Kim TJ, et al. The long-term course of groundglass opacities detected on thin-section computed tomography[J]. Respir Med, 2013,107(6): 904-10. |
| [2] | Lee KH, Goo JM, Park SJ, et al. Correlation between the size of the solid component on thin-section CT and the invasive component on pathology in small lung adenocarcinomas manifesting as ground-glass nodules[J]. J Thorac Oncol, 2014, 9(1): 74-82. |
| [3] | Xu J, Liu CF, Geng LL, et al. Combined score assessment of clinical and imaging features in diagnosis of bronchioloalveolar carcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2012, 39(6): 705-9.[徐 健, 刘春芳, 庚俐丽, 等.临床和影像特征联合评分在细支气管肺泡癌诊断中的作用评估[J]. 肿瘤防治研究, 2012, 39(6): 705-9.] |
| [4] | Lozano MD, Zulueta JJ, Echeveste JI, et al. Assessment of epidermal growth factor receptor and K-ras mutation status in cytological stained smears of non-small cell lung cancer patients: correlation with clinical outcomes[J]. Oncologist, 2011, 16 (6): 877-85. |
| [5] | Meng D, Yuan M, Li X, et al. Prognostic value of K-RAS mutations in patients with non-small cell lung cancer: a systematic review with meta-analysis[J]. Lung Cancer, 2013, 81(1): 1-10. |
| [6] | Lin CC, Yang JC. Optimal management of patients with nonsmall cell lung cancer and epidermal growth factor receptor mutations[J].Drugs, 2011, 71(1): 79-88. |
| [7] | Pao W, Wang TY, Riely GJ, et al. KRAS mutations and primary resistance of lung adenocarcinomas to gefitinib or erlotinib[J]. PLoS Med, 2005, 2(1): e17. |
| [8] | Wu JY, Shih JY, Chen KY, et al. Gefitinib therapy in patients with advanced non-small cell lung cancer with or without testing for epidermal growth factor receptor (EGFR) mutations[J]. Medicine (Baltimore), 2011, 90(3): 159-67. |
| [9] | Lim HJ, Ahn S, Lee KS, et al. Persistent pure ground-glass opacity lung nodules ≥?10 mm in diameter at CT scan: histopathologic comparisons and prognostic implications[J]. Chest, 2013, 144(4): 1291-9. |
| [10] | Cho S, Yang H, Kim K, et al. Pathology and prognosis of persistent stable pure ground-glass opacity nodules after surgical resection[J]. Ann Thorac Surg, 2013, 96(4): 1190-5. |
| [11] | Song YS, Park CM, Park SJ, et al. Volume and mass doubling times of persistent pulmonary subsolid nodules detected in patients without known malignancy[J]. Radiology, 2014, 273(1): 276-84. |
| [12] | Wu YL, Fukuoka M, Mok TS, et al. Tumor response and healthrelated quality of life in clinically selected patients from Asia with advanced non-small-cell lung cancer treated with firstline gefitinib: post hoc analyses from the IPASS study[J]. Lung Cancer, 2013, 81(2): 280-7. |
| [13] | Ludovini V, Bianconi F, Pistola L, et al. Phosphoinositide-3-kinase catalytic alpha and KRAS mutations are important predictors of resistance to therapy with epidermal growth factor receptor tyrosine kinase inhibitors in patients with advanced non-small cell lung cancer[J]. J Thorac Oncol, 2011, 6(4): 707-15. |
| [14] | Mao C, Qiu LX, Liao RY, et al. KRAS mutations and resistance to EGFR-TKIs treatment in patients with non-small cell lung cancer: a meta-analysis of 22 studies[J]. Lung Cancer, 2010, 69(3): 272-8. |
 2014, Vol. 41
2014, Vol. 41
