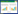文章信息
- 刘亮,贺红梅,左静,左连富. 2014.
- LIU Liang, HE Hongmei, ZUO Jing, ZUO Lianfu. 2014.
- 食管上皮癌变过程中NF-κB与hTERT的表达及其意义
- NF-κB and hTERT Expression in Esophagus Epithelial Canceration and Related Significance
- 肿瘤防治研究, 2014, 41(12): 1304-1306
- Cancer Research on Prevention and Treatment, 2014, 41 (12): 1304-1306
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.12.011
-
文章历史
- 收稿日期:2013-12-31
- 修回日期:2014-04-18
食管癌是常见的消化道恶性肿瘤,其发生及发展是一个多基因参与、多步骤的复杂过程,其确切发病机制仍不清楚。肿瘤细胞与正常细胞的主要不同点在于其失控性生长及无限增殖能力,端粒酶的激活恰是肿瘤细胞获得永生化的主要途径[1,2,3]。人类端粒酶逆转录酶(hTERT)是端粒酶成分中的限速亚单位[4,5],而hTERT的表达是受多方面因素共同调控的[6,7,8]。本研究通过对食管癌变过程中核因子-кB(NF-кB)和人类端粒酶逆转录酶(hTERT)在组织中的表达及相关性研究,试图阐述食管癌变的可能机制。1 材料与方法1.1 组织标本来源及一般资料
取自河北医科大学第四医院病理科2004年10月—2005年3月经手术切除的食管癌标本45例,其中男30例、女15例,年龄40~74岁,中位年龄56岁。所有患者术前均未进行任何抗癌治疗,均经病理检查证实为鳞状细胞癌。由两位年资较高的病理科医生根据1990年WHO食管癌的病理分级标准将45例食管鳞状细胞癌分为高、中、低三级,高分化鳞癌18例、中分化鳞癌14例、低分化鳞癌13例;有淋巴结转移的鳞癌20例、无淋巴结转移的鳞癌25例;侵及纤维膜或周围软组织者29例、未侵及纤维膜者16例;同时取21例距离癌组织2 cm内的癌旁不典型增生组织和24例切缘正常黏膜组织,所有标本经4%多聚甲醛固定,石蜡包埋,用于免疫组织化学检测。1.2 主要试剂
兔抗人hTERT多克隆 抗体(PC563T)购自Calbiochem公司;兔抗人NF-κB多克隆抗体(ZA-0210)购自美国santa 公司;即用型SP-9000试剂盒及DAB显色试剂盒购自北京中杉生物技术有限公司。1.3 方法1.3.1 免疫组织化学方法
免疫组织化学染色采用常规的SP方法,所用载玻片均经APES处理,连续切片厚5 μm,一抗分别为hTERT (1:40稀释)及NF-κB (1:80稀释),二抗为生物素化IgG,以PBS代替一抗作阴性对照。 1.3.2 hTERT及NF-κB蛋白表达结果判断标准
hTERT结果判断:免疫组织化学结果以细胞质中出现棕黄色颗粒为阳性,光学显微镜下每张切片在诊断确定的食管癌组织中随机选取5个高倍视野,每个视野计数200个细胞,共计1 000个,染色强度分级如下:无着色为0,淡黄色为1,黄色及更深颜色为2;阳性细胞数分级为:阳性细胞数≤50%为0,50%~75%为1,>75%为2。两项得分相乘结果≥2为阳性表达病例。NF-κB结果判断:按照参考文献[9]报告的方法,免疫组织化学结果以细胞质和细胞核中出现棕黄色颗粒为NF-κB阳性,光学显微镜下每张切片在诊断确定的食管癌组织中随机选取5个高倍视野,每个视野计数200个细胞,共计1 000个,染色强度分级如下:无着色为0,淡黄色为1,深黄色为2;阳性细胞数分级为:阳性细胞数≤50%为0,50%~75%为1,>75%为2。两项得分相乘结果≥2为阳性表达病例。 1.4 统计学方法
计数资料计算阳性率,阳性率之间的比较采用χ2检验,P<0.05为差异有统计学意义,所有统计均由SASv8统计软件包完成。 2 结果 2.1 不同食管病变组织中hTERT蛋白的表达水平
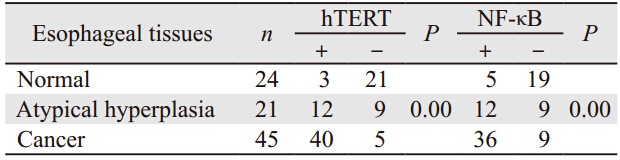
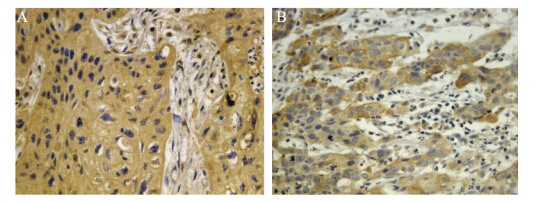
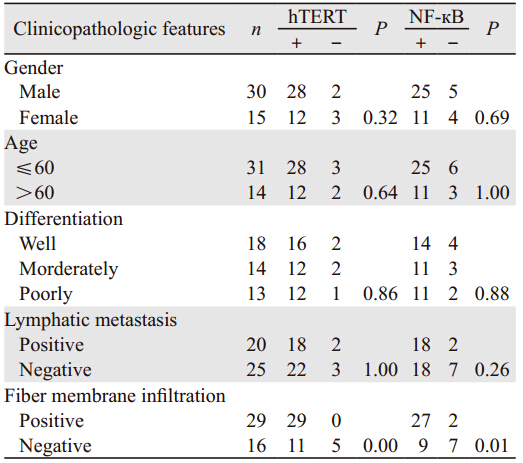
免疫组织化学检测结果显示,hTERT蛋白阳性产物主要定位于细胞质,见图 1A。食管癌组织中hTERT蛋白阳性表达率显著高于不典型增生及正常组织(P=0.00),见表 1。食管癌组织中hTERT蛋白表达与不同临床参数之间的关系,见表 2,其中有纤维膜浸润者显著高于无纤维膜浸润者(P=0.00)。
|
| A: hTERT protein(IHC×400); B: NF-κB protein(IHC×400) 图 1 食管癌组织中hTERT与NF-κB蛋白的表达 Figure 1 hTERT and NF-κB protein expression levels in esophageal cancer tissues detected |
NF-кB蛋白阳性产物主要定位于细胞质和细胞核,高表达主要见于癌组织呈棕黄色颗粒散在分布,见图 1B。不典型增生和切缘正常组织低表达。食管癌组织中NF-κB蛋白阳性表达率显著高于不典型增生及正常组织(P=0.00),见表 1。食管癌组织中NF-κB蛋白表达与不同临床参数之间的关系见表 2,其中有纤维膜浸润者显著高于无纤维膜浸润者(P=0.01)。
 |
在食管癌组织中hTERT蛋白阳性表达与NF-κB阳性蛋白表达具有正相关性(r=0.354,P=0.017)。 3 讨论
癌细胞的永生化是肿瘤细胞区别于正常细胞的重要特征之一,也是肿瘤发生及发展的关键。自从1989年Morin首次在人癌细胞中发现端粒酶以来,肿瘤细胞永生化的“端粒-端粒酶”假说已被越来越多的研究结果所证实。端粒酶是合成端粒DNA的逆转录酶。对防止染色体复制过程中端粒发生融合、重组、变短等起重要作用。成人除骨髓、生殖细胞以及正常胚胎性组织外,大多数体细胞中几乎检测不到端粒酶高表达。而在恶性肿瘤中,端粒酶多呈高表达[10]。现已证明端粒酶有三个主要成分[11]:端粒酶RNA(hTR)、端粒酶相关蛋白(TP1/TLP1)、端粒酶催化亚单位(TERT)。其中TERT为端粒酶活性的必需和限速成分,其水平决定细胞端粒酶活性[12]。成人膀胱上皮癌、肺癌、乳腺癌中80%~90%的端粒酶表达为阳性,并与hTERT mRNA活性相一致[13],抑制hTERT可降低端粒酶活性,抑制癌细胞的生长;而hTERT的导入可使正常细胞端粒酶活性增高,使细胞的寿命延长。并且研究表明瘤组织中hTERT mRNA高表达者往往提示预后较差[14]。大部分肿瘤细胞中hTERT在端粒酶活性增高、端粒长度维持、细胞永生化及恶性转化中起决定作用。本研究发现食管癌组织中hTERT蛋白表达显著高于食管不典型增生及正常组织,提示高表达的hTERT蛋白可能参与了食管癌的早期发生。进一步探讨食管癌组织中hTERT蛋白表达与不同临床病理特征的关系,结果显示,有、无纤维膜浸润的食管癌组织中hTERT蛋白的阳性表达率有显著差异,提示hTERT蛋白的异常表达可能与食管癌的局部浸润及远处转移有关。hTERT蛋白的高表达可能参与了食管癌细胞永生化的过程。
NF-κB是一种重要的核转录因子,主要以p50、p65组成的二聚体形式存在。在活化因素的刺激下,NF-κB活化,进入细胞核和相应的靶基因结合,发挥其转录因子的作用,促进细胞增殖。本研究的结果显示,NF-κB在食管癌组织中高表达,且与有、无纤维膜浸润相关,提示其异常表达可能参与了食管癌的发生及发展,并与食管癌的局部浸润有关。
近来的研究发现,NF-κB在hTERT转录、核内转移等过程中均发挥重要作用。一方面,NF-κB可以激活hTERT启动子。Sinha-Datta等[15]发现转染了Tax的T细胞中Tax通过NF-κB途径激活了hTERT启动子。另一方面,NF-κB可以促进hTERT的核内移位过程。本研究的结果显示,食管癌组织中的NF-κB与hTERT蛋白表达呈正相关性。提示,NF-κB可能通过调节hTERT作用从而使食管癌细胞具有旺盛增殖能力和永生化作用。
本研究为食管癌发生机制的研究提供实验基础,为食管癌早期诊断及预后判断提供客观指标,对于临床上食管癌患者早期诊断及治疗具有重大意义。
| [1] | Nakashima M, Nandakumar J, Sullivan KD, et al. Inhibitionof tel omerase recruitment and cancer cell death[J].J Biol Chem, 2013, 288(46): 33171-80. |
| [2] | Pal J, Gold JS, Munshi NC, et al. Biology of telomeres: importance in etiology of esophageal cancer and as therapeutic target[J]. Transl Res, 2013, 162(6): 364-70. |
| [3] | Basu N, Skinner HG, Litzelman K, et al. Telomeres and telomere dynamics: relevance to cancers of the GI tract[J]. Expert Rev Gastroenterol Hepatol, 2013, 7(8): 733-48. |
| [4] | Harkisheimer M, Mason M, Shuvaeva E, et al. A motif in the vertebrate telomerase n-terminal linker of tert contributes to rna binding and telomerase activity and processivity[J]. Structure, 2013, 21(10): 1870-8. |
| [5] | Zhang D, Wen X, Wu W, et al. Homocysteine-related hTERT DNA demethylation contributes to shortened leukocyte telomere length in atherosclerosis[J]. Atherosclerosis, 2013, 231(1): 173-9. |
| [6] | Mazumdar T, Sandhu R, Qadan M, et al. Hedgehog signaling reg ulates telomerase reverse transcriptase in human cancer cells[J]. PLoS One, 2013, 8(9): e75253. |
| [7] | Lv LP, Kong YL, Yan F, et al. Hepatocytes transduced with human TERT gene acquire a prolonged lifespan in culture and retain permissiveness to hepatitis B virus [J]. Acta Virol, 2013, 57(3): 305-11. |
| [8] | Nonoguchi N, Ohta T, Oh JE, et al. TERT promoter mutations in primary and secondary glioblastomas[J]. Acta Neuropathol, 2013, 126(6): 931-7. |
| [9] | Lind DS, Hochwald SN, Malaty J, el al. Nuclear factor-kappa B is upregulated in colorectal cancer[J]. Surgery, 2001, 130(2): 363-9. |
| [10] | Hahn WC. Role of telomerase in the pathogenesis of human cancer[J]. J Clin Oncol, 2003, 21(10): 2034-43. |
| [11] | Feng J, Funk WD, Wang SS, et al. The RNA component of human telomerase[J]. Science, 1995, 269(5228): 1236-41. |
| [12] | Koyanagi Y, Kobayashi D, Yajima T, et al. Telomerase activation is down regulated via decrease in hTERT mRNA but not TEP1 mRNA or hTERC during the differentiation of leukemia cells[J]. Anticancer Res, 2000, 20(3A): 773-8. |
| [13] | Hilbe W, Dirnhofer S, Greil R, et al. Biomarkers in non-small cell lung cancer prevention [J]. Eur J Cancer Prev,2004,13(5): 425-36. |
| [14] | Wang L, Soria JC, Kemp BL, et al. hTERT expression is a prognostic factor of survival in patients with stage I non-small cell lung cancer [J]. Clin Cancer Res, 2002, 8(9): 2883-9. |
| [15] | Sinha-Datta U, Horikawa I, Michishita E, et al.Transcriptional activation of hTERT through the NF-{kappa}B pathway in HTLVI-transformed cells[J]. Blood, 2004, 104(8): 2523-31. |
 2014, Vol. 41
2014, Vol. 41