文章信息
- 林松,邵增务,范磊,马秀才,浦飞飞,杨昊飞. 2014.
- LIN Song, SHAO Zengwu, FAN Lei, MA Xiucai, PU Feifei, YANG Haofei. 2014.
- 微小RNA-101对人骨肉瘤细胞自噬和侵袭性的影响
- Effects of microRNA-101 on Invasion and Autophagy of Human Osteosarcoma Cells
- 肿瘤防治研究, 2014, 41(12): 1296-1299
- Cancer Research on Prevention and Treatment, 2014, 41(12): 1296-1299
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.12.009
-
文章历史
- 收稿日期:2013-11-21
- 修回日期:2014-05-15
近年来微小RNA与自噬研究备受关注,成 为细胞生物学研究热点。它们涉及真核细胞基因 表达、发育分化、细胞凋亡、应激等多方面调 控,广泛参与生物体生长发育、免疫防御、肿瘤抑制等多种病理生理过程。已有研究表明[1, 2, 3, 4], RNA-101(microRNA-101,miR-101)在肺癌、 肝癌、前列腺癌、乳腺癌、胃癌等多种肿瘤中表 达下调,可能发挥着抑癌基因的功能。而自噬是 肿瘤细胞增殖、成活的重要机制之一,对肿瘤细 胞的侵袭、转移有着重要的促进作用[5, 6, 7]。本研究 以骨肉瘤组织和细胞为研究对象,检测miR-101与 自噬相关蛋白的表达,并通过脂质体转染miR-101 模拟物使其过表达,观察骨肉瘤细胞转染前、后 细胞自噬水平的改变及转染后细胞侵袭能力的变 化,探讨miR-101影响细胞侵袭能力的可能机制。 1 资料与方法 1.1 临床资料
收集2011年3月至2013年6月华中科技大学同济 医学院附属协和医院骨科手术切除的31例骨肉瘤组 织标本,并均经病理确诊。其中男18例,女13例, 年龄6~48岁,平均(22.42±9.85)岁。因放、化疗 可能会干扰肿瘤组织微小RNA的表达,故本研究 中的入选患者术前均未接受放、化疗。入选来源主 要包括:(1)肿瘤恶性程度高、范围广,无法保 肢,患者要求截肢后再化疗;(2)患者全身情况 不能耐受化疗,只行姑息性病灶切除;(3)部分 误诊患者,来诊时已不能保肢治疗;(4)外院手 术患者,局灶性复发,要求术后再化疗等。新鲜标 本切取后给予编号和登记,后置于液氮中-80℃保 存。癌旁组织取距离实体肿瘤边缘≥3 cm的骨膜组 织,经病理检查未发现肿瘤细胞。31例正常骨组织 标本来源于髋关节置换之股骨头正常骨质。所有 标本的使用均获得患者及家属知情同意。 1.2 细胞系和主要试剂
骨肉瘤细胞系MG-63由华中科技大学同济医学 院附属同济医院骨科实验室馈赠,人成骨细胞(上 海基尔顿公司),RPMI 1640培养液和胎牛血清 (美国Gibco公司),脂质体转染试剂LipofectamineTM2000 及TRIzol试剂(美国Invitrogen公司), TaqMan miRNA检测试剂盒、Real-Time PCR仪器 (美国AB公司),miR-101模拟物和阴性对照短 双链RNA(negative control)(广州瑞博生物科技 有限公司),Beclin1和LC3一抗(均为兔抗人, 英国Abcam公司),羊抗兔lgG二抗(美国Santa公 司),Transwell小室(美国Corning公司)。 1.3 细胞培养与转染
骨肉瘤细胞系MG-63采用含10%胎牛血清的 RPMI 1640培养液,在37℃、5% CO2条件下培养, 2~3 d换液1次,待细胞融合度达90%时传代,使细 胞保持对数生长状态。取对数生长期细胞接种于6 孔板并分成三组即:空白对照组(未转染组)、 阴性对照组和miR-101模拟物转染组。转染步骤参 照LipofectamineTM2000试剂盒说明书进行。 1.4 组织样本和细胞RNA提取
采用TRIzol法分别提取骨肉瘤组织、癌旁骨 组织、正常骨组织以及骨肉瘤细胞和成骨细胞总 RNA。紫外分光光度计测定纯度,琼脂糖电泳检 测确定RNA完整性后于-80℃下保存备用。 1.5 qRT-PCR检测
根据miRBase(http://www.mirbase.org)提供 的miRNA基因序列设计引物。miR-101正向引物 5’-TACAGTACTGTGATAACTGAA-3’,反向引物 5’-TGGTGTCGTGGAGTCG-3’。U6作为内参, 其正向引物5’-GCTTCGGCAGCACATATACTAAAAT- 3’,反向引物5’-CGCTTCACGAATTTGCGTGTCAT- 3’。PCR扩增反应条件:95℃ 10s,60℃ 20s,72℃ 10s,共40个循环,每组实验重复3次。 反应结束得到各标本和内参U6的基本循环数(Ct 值)。根据2-ΔΔCt值得出miR-101的相对表达量。 1.6 Western bolt实验
常规裂解组织和细胞,考马斯亮蓝法进行蛋 白定量,电泳、转印和封闭后,分别加Beclin1抗体 (1∶500)和LC3抗体(1∶400)4℃孵育过夜。次日, 辣根过氧化物酶标记的羊抗兔lgG二抗(1∶40 000) 孵育,PBS漂洗,二氨基联苯胺(DAB)显色。Gel pro4.0凝胶光密度分析软件进行分析,同一条件下 测定目标条带累积吸光度值以及内参GAPDH累积吸 光度值,计算两者比值作为其相对蛋白表达量。 1.7 Transwell侵袭实验
骨肉瘤MG- 6 3 细胞分成三组即空白组、 miR-101模拟物组和阴性对照组。转染24 h后消化 细胞,无血清的BSA培养液重悬。以每孔2×104细 胞数加入小室,下室加含10%胎牛血清(FBS)培 养液。37℃、无CO2培养箱培养24 h,室温下95% 乙醇固定20 min,苏木精染色10 min,三蒸水清洗 后倒置显微镜下随机选取5个视野观察照相(放大 倍数200),比较组间穿过细胞数的差异。 1.8 统计学方法
本实验数据以均数±标准差(x±s)表示,采用 SPSS19.0统计软件进行数据分析。两组间比较采用 t检验,多组间比较采用方差分析,组间多重比较 采用LSD-t检验,以P<0.05为差异有统计学意义。 2 结果 2.1 miR-101在骨肉瘤组织和骨肉瘤细胞中的表达
qRT-PCR检测骨肉瘤组织、癌旁骨组织和正常 骨组织中miR-101的相对表达,结果显示miR-101 在三组样本中均有表达,且骨肉瘤组织中miR-101 的表达(1.29±0.25)显著低于癌旁骨组织(3.05± 0.27)和正常骨组织(3.38±0.26),差异有统计学 意义(P<0.01),见图 1。成骨细胞miR-101的相 对表达量(2.56±0.27)是骨肉瘤MG-63细胞(1.52 ±0.20)的1.68倍(P<0.01),见图 2。
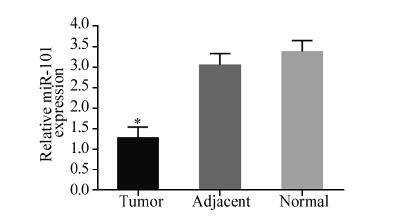
|
| Tumor: osteosarcoma tissues; Adjacent: non-neoplastic bone tissues; Normal: normal bone tissues; *: P<0.01,compared with normal bone tissues (x±s,n=3) 图 1 qRT-PCR检测骨肉瘤组织、癌旁骨组织以及正常骨 组织miR-101相对表达量 Figure 1 Relative expression of miR-101 in osteosarcoma tissues,adjacent non-neoplastic bone tissues,and normal bone tissues measured by qRT-PCR |
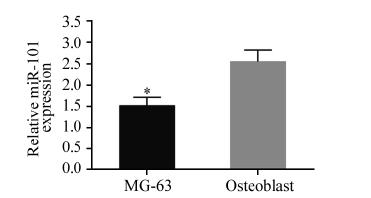
|
| MG-63: MG-63 cells; *: P<0.05,compared with osteoblast (x±s,n=3) 图 2 qRT-PCR检测骨肉瘤MG-63细胞和成骨细胞miR-101 的相对表达量 Figure 2 Relative expression of miR-101 in MG-63 cells and osteoblast detected by qRT-PCR |
转染48 h后收集细胞,qRT-PCR检测三组细胞 miR-101的相对表达量,分别是空白对照组(1.31± 0.32)、阴性对照组(1.35±0.31)和miR-101模拟物转染 组(3.86±0.28)。模拟物转染组miR-101表达量较空白 对照组上调了255%,差异有统计学意义(F=70.28, P<0.01)。而阴性对照组miR-101的表达和空白对照组 相比,差异无统计学意义(P=0.87),见图 3。
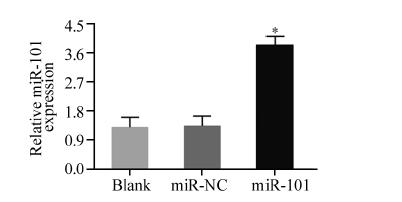
|
| Blank: blank control group; miR-NC: miR-101 negative control group; miR-101: miR-101 mimics group; *: P<0.01,compared with blank control group (x±s,n=3) 图 3 qRT-PCR检测转染后三组细胞miR-101的相对表达量 Figure 3 Relative expression of miR-101 in three groups after transfection detected by qRT-PCR |
Western blot检测骨肉瘤MG-63细胞和成骨细胞自噬相关蛋白Beclin1和LC3B的相对表达,结 果显示骨肉瘤细胞组Beclin1和LC3B蛋白相对表 达量均显著低于成骨细胞组,差异有统计学意义 (P<0.05),见表 1。
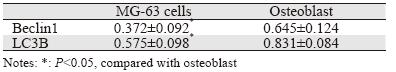 |
转染48 h后收集细胞,Western blot再次检测三 组细胞自噬相关蛋白Beclin1和LC3B的相对表达, 结果显示,与空白对照组和阴性对照组相比, miR-101模拟物转染组Beclin1和LC3B蛋白的表达 显著减低,差异有统计学意义(P<0.01)。而阴 性对照组与空白对照组比较,两自噬相关蛋白的 表达差异无统计学意义(P>0.05),见表 2。
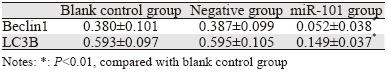 |
转染48 h后收集细胞,Western blot再次检测三 Transwell实验表明,miR-101转染组细胞迁 移数目(56.00±9.85)较阴性对照组(116.00± 7.94)和空白对照组(123.67±9.71)分别减少了 60%和67.67%,差异有统计学意义(F=48.58, P<0.01)。空白对照组和阴性对照组比较差异无 统计学意义(P=0.35),见图 4。
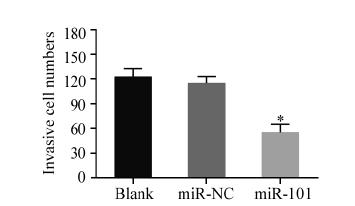
|
| *: P<0.01,compared with blank control group (x±s,n=3) 图 4 Transwell检测上调miR-101对骨肉瘤细胞侵袭性的影响 Figure 4 Effects of upregulating miR-101 expression on invasion of MG-63 cells evaluated by Transwell assay |
骨肉瘤是一种好发于青少年的常见恶性成骨 性肿瘤,其恶性程度高预后差,5年生存率仅为 55%~68%[8],绝大多数患者最终发生了肿瘤性转 移。因此,寻找新的、有效的治疗措施,提高患者 生存率,阻止或延缓骨肉瘤的转移成为当务之急。 研究表明,微小RNA(miRNAs)具有广泛的基因 调节功能,参与生物体生长发育、细胞增殖、肿 瘤抑制等多种病理生理过程[9]且miRNAs的表达失 调与肿瘤的发生、发展及肿瘤预后密切相关[4, 10]。 Fan等[11]研究提示正常情况下,miR-145在骨肉瘤 细胞中呈低表达状态。而应用转染技术,转染外 源性miR-145至骨肉瘤细胞,使骨肉瘤细胞过表达 miR-145则可有效阻止肿瘤血管的形成,抑制骨肉 瘤细胞的转移。Yang等[12]研究表明在非小细胞肺癌 患者中miR-21与miR-155的异常高表达可预示患者 的肿瘤高再发率和不良预后。miR-101作为miRNAs 家族中重要成员之一,已被证实在膀胱癌、胃癌、 乳腺癌等多种实体肿瘤中呈现低表达[1, 2, 3, 13, 14],影响 着肿瘤细胞的生长和侵袭,被认为具有抑癌基因 功能。Hu等[1]研究发现miR-101在膀胱癌组织中表 达下调,过表达miR-101可抑制癌细胞的迁移和侵 袭。本研究中,qRT-PCR结果显示在骨肉瘤组织和 骨肉瘤细胞系,miR-101的表达均显著下降,提示 miR-101可能参与了骨肉瘤的发生、发展,影响着 骨肉瘤细胞的生长和侵袭。
自噬作为细胞在异常环境中维持生存的一种 方式,对肿瘤细胞的凋亡、侵袭和转移同样起着 重要的调节作用[5, 6, 7, 15]。Zhang等[16]研究表明自噬与 骨肉瘤的发生密切相关,抑制自噬可增强骨肉瘤 细胞对化疗药物的敏感度。自噬和miR-101均与肿 瘤细胞的侵袭密切相关,但两者对骨肉瘤细胞的 影响鲜见报道。本研究中,Transwell侵袭实验表 明,模拟物转染组骨肉瘤细胞迁移的数目明显低 于空白及阴性对照组,提示miR-101对骨肉瘤细胞 的迁移有明显的抑制作用,可延缓或阻止肿瘤细 胞转移。Western blot结果显示,miR-101转染组 细胞自噬相关蛋白Beclin1和LC3B的表达与空白组 和阴性对照组相比显著减低,表明miR-101不仅可 抑制骨肉瘤细胞的侵袭还同时降低了骨肉瘤细胞 的自噬水平,这一结果与已有的研究发现保持一 致。Frankel等[17]通过对乳腺癌细胞系MCF-7细胞 转染真核LC3质粒,量化细胞自噬体形成百分比以 及敲除Beclin1基因,证实miR-101具有显著的抑制 自噬作用。Xu等[18]在对肝细胞癌细胞系的研究中 也发现miR-101可明显抑制自噬,增加顺铂诱导的 癌细胞凋亡。故我们推测本实验中miR-101抑制骨 肉瘤细胞侵袭很可能也是通过了抑制骨肉瘤细胞 自噬而发挥作用。
综上所述,miR-101可有效抑制骨肉瘤细胞侵袭 和自噬且可能是通过降低细胞自噬而影响癌细胞侵 袭性,但具体分子机制仍不明确,有待进一步研究。 随着对miR-101及自噬的深入探索,其有望成为骨肉 瘤治疗的新靶点,为骨肉瘤的治疗提供新思路。
| [1] | Hu Z, Lin Y, Chen H, et al. MicroRNA-101 suppresses motility ofbladder cancer cells by targeting c-Met[J]. Biochem Biophys ResCommun, 2013, 435(1): 82-7. |
| [2] | Wang R, Wang HB, Hao CJ, et al. MiR-101 is involved in humanbreast carcinogenesis by targeting Stathmin1[J]. PLoS One, 2012,7(10): e46173. |
| [3] | He XP, Shao Y, Li XL, et al. Downregulation of miR-101 in gastriccancer correlates with cyclooxygenase-2 overexpression andtumor growth[J]. FEBS J, 2012, 279(22): 4201-12. |
| [4] | Luo L, Zhang T, Liu H, et al. MiR-101 and Mcl-1 in non-smallcelllung cancer: expression profile and clinical significance[J].Med Oncol, 2012, 29(3): 1681-6. |
| [5] | Lock R, Debnath J. Extracellular matrix regulation of autophagy[J].Curr Opin Cell Biol, 2008, 20(5): 583-8. |
| [6] | Chaabane W, User SD, El-Gazzah M, et al. Autophagy, apoptosis,mitoptosis and necrosis: interdependence between those pathwaysand effects on cancer[J]. Arch Immunol Ther Exp (Warsz), 2013,61(1): 43-58. |
| [7] | Choi AM, Ryter SW, Levine B. Autophagy in human health anddisease[J]. N Engl J Med, 2013, 368(7): 651-62. |
| [8] | Ottaviani G, Jaffe N. The epidemiology of osteosarcoma[J]. CancerTreat Res, 2009, 152: 3-13. |
| [9] | Lujambio A, Lowe SW. The microcosmos of cancer[J]. Nature,2012, 482(7385): 347-55. |
| [10] | Hao Y, Gu X, Zhao Y, et al. Enforced expression of miR-101inhibits prostate cancer cell growth by modulating the COX-2pathway in vivo[J]. Cancer Prev Res (Phila), 2011, 4(7): 1073-83. |
| [11] | Fan L, Wu Q, Xing X, et al. MicroRNA-145 targets vascularendothelial growth factor and inhibits invasion and metastasisof osteosarcoma cells[J]. Acta Biochim Biophys Sin (Shanghai),2012, 44(5): 407-14. |
| [12] | Yang M, Shen H, Qiu C, et al. High expression of miR-21 andmiR-155 predicts recurrence and unfavourable survival in nonsmallcell lung cancer[J]. Eur J Cancer, 2013, 49(3): 604-15. |
| [13] | Strillacci A, Valerii MC, Sansone P, et al. Loss of miR-101expression promotes Wnt/β-catenin signalling pathway activationand malignancy in colon cancer cells[J]. J Pathol, 2013, 229(3):379-89. |
| [14] | Wang HJ, Ruan HJ, He XJ, et al. MicroRNA-101 is downregulatedin gastric cancer and involved in cell migration andinvasion[J]. Eur J Cancer, 2010, 46(12): 2295-303. |
| [15] | Espina V, Wysolmerski J, Edmiston K, et al. Attacking breastcancer at the preinvasion stage by targeting autophagy[J]. WomensHealth (Lond Engl), 2013, 9(2): 157-70. |
| [16] | Zhang Z, Shao Z, Xiong L, et al. Expression of Beclin1 inosteosarcoma and the effects of down-regulation of autophagyon the chemotherapeutic sensitivity[J]. J Huazhong Univ SciTechnolog Med Sci, 2009, 29(6): 737-40. |
| [17] | Frankel LB, Wen J, Lees M, et al. microRNA-101 is a potentinhibitor of autophagy[J]. EMBO J, 2011, 30(22): 4628-41. |
| [18] | Xu Y, An Y, Wang Y, et al. miR-101 inhibits autophagy andenhances cisplatin-induced apoptosis in hepatocellular carcinomacells[J]. Oncol Rep, 2013, 29(5): 2019-24. |
 2014, Vol. 41
2014, Vol. 41


