文章信息
- 徐伟立,蔡建辉,李索林,问明,温军业. 2014.
- XU Weili, CAI Jianhui, LI Suolin, WEN Ming, WEN Junye. 2014.
- 干扰肿瘤微环境对细胞毒性T淋巴细胞瘤体内归巢和杀伤活性的影响
- Effect of Interfering Tumor Microenvironment on Homing and Killing Activity of Cytotoxic T Lymphocytes
- 肿瘤防治研究, 2014, 41(12): 1286-1291
- Cancer Research on Prevention and Treatment, 2014, 41(12): 1286-1291
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.12.007
-
文章历史
- 收稿日期:2013-11-15
- 修回日期:2014-04-30
过继性免疫治疗是一种行之有效的肿瘤治疗 方法,但临床上常常会陷入困境,原因和回输体 内的效应细胞归巢存留时间短、杀伤效率低和肿 瘤免疫耐受等有关[1, 2]。肿瘤微环境中高水平的调 节性T细胞(regulatory T cells,Treg)、白细胞介素-10(interleukin-10,IL-10)和转化生长因子-β (transforming growth factor beta,TGF-β)被认为 是诱导肿瘤免疫耐受的重要因素[3]。如何有效下调 这些免疫抑制因素,改善效应细胞瘤体内存留分 布和杀伤效率对于提高肿瘤免疫疗效十分重要。
环磷酰胺(cyclophosphamide,CYC)是一种 常用的细胞毒化疗药物,同时也是一种免疫抑制 剂。有研究证明[4],单次小剂量CYC在数量上及功 能上都具有抑制Treg作用,但不能延缓肿瘤生长。 而有关CYC应用在降低Treg同时,是否也能降低 IL-10和TGF-β等免疫抑制因子,改善效应细胞体 内分布和功能则未见报道。因此,我们采用低剂 量CYC腹腔注入对C57BL/6荷黑色素瘤小鼠体内 微环境进行提前干预,利用荧光染料2-羧基荧光 素二醋酸盐琥珀酰亚胺酯(5,6-carboxyfluorescein diacetate succinimidyl ester,CFSE)标记抗原特异 性细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL)回输小鼠体内,以探讨应用低剂量CYC对 瘤体内Treg、IL-10和TGF-β影响以及对改善过继回 输的CTL瘤体内归巢聚集和杀伤功能的重要作用。 1 材料与方法 1.1 实验动物和肿瘤细胞
恶性黑色素瘤细胞(B16细胞)株购自中国 科学院上海细胞库。置于含10%灭活FBS、100 u/ml 青霉素和100 μg/ml 链霉素的RPMI 1640培养 液中,于37℃、5%CO2保湿培养箱中培养。健康 C57BL/6小鼠均为雌性,6~8周龄,体重18~20g, 购自河北省实验动物中心[SPF级,许可证编号: SYXK(冀)2008-0026]。 1.2 方法 1.2.1 肿瘤全抗原制备和负载于树突状细胞 (dendritic cell,DC)
收集对数生长期B16细胞, 调整浓度至2×107个/毫升,快速冷冻至-80℃, 于37℃水浴复温,循环4次,10000 r/min 离心15 min,收集上清液,于-80℃冻存备用。颈椎脱位 法处死小鼠,无菌取股骨和胫骨。以RPMI 1640冲 洗收集骨髓,1 500 r/min离心5 min。弃上清液, 裂解红细胞,细胞按1×106/ml浓度分至6孔培养 板中,加入rmGM-CSF(20 ng/ml)、rmIL-4(20 ng/ml)。第6天按每毫升培养液加入120 μg B16细 胞裂解蛋白,4 h后再加入rmTNF-α(15 ng/ml), 培养至第7天,收集悬浮细胞即为负载肿瘤抗原的 DC。 1.2.2 抗原特异性CTL制备
制备小鼠脾脏淋巴细 胞悬液,依据Mouse CD3+ T Cell 磁珠分选试剂盒说 明提取CD3+ T细胞,培养2天后加入负载肿瘤抗原的 DC(DC:T=1:20),同时补充 rmIL-2(20 ng/ml), 置37℃、5%CO2培养箱中混合培养3~4天,DC将 所负载的肿瘤抗原信息提呈给T细胞,使之激活并 进一步扩增。 1.2.3 CFSE对CTL荧光标记和CD8+CTL检测
用一瓶50 μg CellTraceTM CFSE溶于18 μl DMSO中,制备5 mmol/L CFSE贮存液。重悬CTL 于37℃预温的含5%胎牛血清的PBS,细胞浓度≤ 50×106/ml,反应体系为1 ml。放平干燥的试管,
将110 μl PBS加入试管头端干燥部分,并将1.1 μl 5 mmol/L的CFSE重悬其中,使终浓度为5 μmol/L。 37℃孵育10 min。加入5倍体积4℃冷PBS,终止 染色。冰上孵育5 min。1 500 r/min离心沉淀细胞5 min。含5%胎牛血清的新鲜培养液洗2次。回输时 用不含血清的培养液重悬细胞。流式细胞仪,激 发波长488 nm进行检测,同时荧光显微镜观察。 将100 μl染色后CTL重悬,调整浓度为1×107个/毫升, 加1 ml新鲜破膜工作液,暗处4℃孵化30 min;2 ml破 膜缓冲液洗涤细胞,2 500 r/min离心5 min,弃上 清液;重复操作后,加入0.5 μg Fc受体封闭破膜缓 冲液,体积调整至100 μl,4℃放置15 min;加入 0.5 μg小鼠PE-Cy5-CD8+抗体,暗处4℃孵化30 min;用 2 ml破膜缓冲液洗涤细胞,3 500 r/min离心5 min, 弃上清液;重复后悬浮细胞,流式细胞学检测 CD8+CTL比例。 1.2.4 C57BL/6小鼠黑色素瘤模型建立和分组
取对数生长期B16细胞,0.25%胰蛋白酶消 化,调整浓度至5×105/ml,取瘤细胞悬液0.2 ml 皮下接种于小鼠颈后区域,7天后皮下可及直径 约5 mm左右质硬黑色结节,界限清楚,视为建 模成功。将模型鼠分为四组:CYC注入组(CYC injection group,CYCI),0.9%NaCl溶液注入+CTL 回输组(the solution of 0.9% w/v of NaCl injection plus CTL infusion group,NSI+CTL),CYC注入 +CTL回输组(CYC injection plus CTL infusion group, CYCI+CTL)和对照组(不实施任何治疗干预组)。 分别于建模成功时对CYC组和CYCI+CTL组小鼠进 行单次CYC腹腔注入(20 mg/kg)[4],同时NSI+CTL 组小鼠单次注入等体积的0.9%NaCl溶液。各组置无 菌净化屏障系统内饲养,每三日测量肿瘤结节最长 径a和最短径b,根据公式V=1/6π(ab2)计算体积,绘 制肿瘤生长曲线。 1.2.5 小鼠肿瘤内Treg、IL-10和TGF-β水平检测
NSI+CTL和CYCI+CTL两组小鼠分别于CYC或 0.9%NaCl溶液注射前(d0)和注射后d1、d4、 d7、d11及d15各时间点脱颈处死,无菌收集2 mm3 肿瘤组织加入预冷的0.9%NaCl溶液中,清洁表面血 迹,加入组织裂解液50 μl,放入含冰块烧杯,用细胞 超生粉碎仪进行匀浆,直至充分裂解,10 000 r/min 离心5 min后取上清液,分装并置于-20℃保存。 按小鼠Treg流式检测试剂盒说明书对所收集细胞进 行CD4(FITC)CD25(PE)foxp3(PE-cy5)三 标染色后检测瘤体内Treg水平。ELISA法检测小鼠 肿瘤分离上清液中TGF-β和IL-10在注射前后水平 变化,按试剂盒说明书方法进行。 1.2.6 回输CTL瘤体内归巢聚集检测
CYC或NS 注射后第4天,分别经以上两组小鼠鼠尾静脉回输 培养的CFSE-CTL,每只0.2 ml,含5×l06个细胞。分 别于CTL回输后不同时间点(6 h、1 d、3 d、6 d、 10 d、15 d、21 d)脱颈处死小鼠。解剖并称取1 g 重不同时间肿瘤组织,清除脂肪组织后剪碎。置 于200目不锈钢细胞筛上适度研磨,分离收集细 胞。裂解红细胞,Hank’s液洗涤2次,1 000 r/min 离心5 min后弃上清液,RPMI 1640液重悬,调整 浓度至1×107/ml。取单细胞悬液1 ml,与Hank’s液 1∶1混匀,加入2 ml小鼠淋巴细胞分离液,1 500 r/min 离心15 min,取淋巴细胞液层,洗涤2次,流式细 胞仪,激发波长488 nm检测CFSE-CTL阳性细胞比 例。红细胞、细胞碎片通过前向角光散射和对侧 向角光散射分析设定门值排除。同时分别切取两 组CTL回输后不同时间肿瘤组织迅速放置于OCT包 埋剂中,制备15 μm厚冰冻切片,激光共聚焦显微 镜观测肿瘤组织内CFSE阳性细胞分布情况。 1.3 统计学方法
各组数据以均数±标准差(x±s)表示,采用 SAS(V8)软件程序进行统计处理,采用t检验、 单因素方差分析和重复测量方差分析确定差异显 著性,P<0.05为差异有统计学意义。 2 结果 2.1 CFSE对CTL荧光标记和CD8+ CTL检测
利用CFSE对CTL标记后,荧光显微镜下观 察,发现CFSE进入细胞后定位于细胞膜、细胞 质和细胞核,在细胞核的荧光染色最强。倒置显 微镜下对CTL进行对比观察,发现染色率几乎达 100%,见图 1A、1B。加入小鼠CD8+抗体,流式细 胞学检测CD8+ CTL比例,达到41.7%,见图 1C。
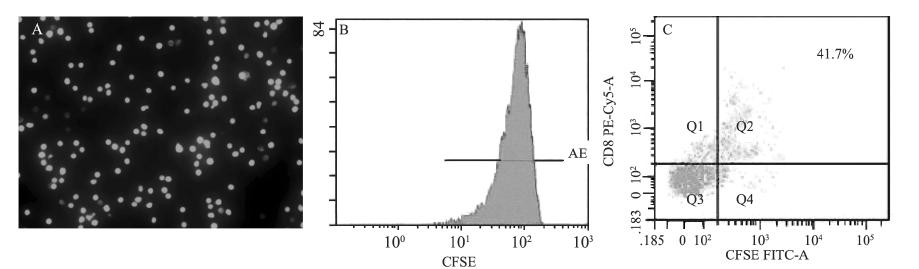
|
| A: CTLs were labeled with CFSE at 5 μmol/L (×1000); B: Fluorescence intensity was analyzed by flow cytometry; C: The ratio of CD8+ CFSE-CTLs was analyzed by flow cytometry; CTLs: cytotoxic T lymphocyte; CFSE: 5,6-carboxyfluorescein diacetate succinimidyl ester 图 1 CTLs荧光标记和流式细胞学分析 Figure 1 Fluorescence labelingand flow cytometry analysis of CTLs |
NSI+CTL组小鼠瘤体内Treg、IL-10和TGF-β水 平均随着肿瘤体积增长而逐渐增高;CYC+CTL组 小鼠瘤体内Treg(P=0.004)和IL-10(P=0.002) 水平均于CYC注射后第4天显著降低,与对照组相 比差异有统计学意义,见图 2A、2B,以后逐渐提 升;CYC组小鼠瘤体内TGF-β水平则推迟至CYC注 射后第7天时降低至最低水平,与对照组相比差异 有统计学意义(P=0.003),见图 2B。
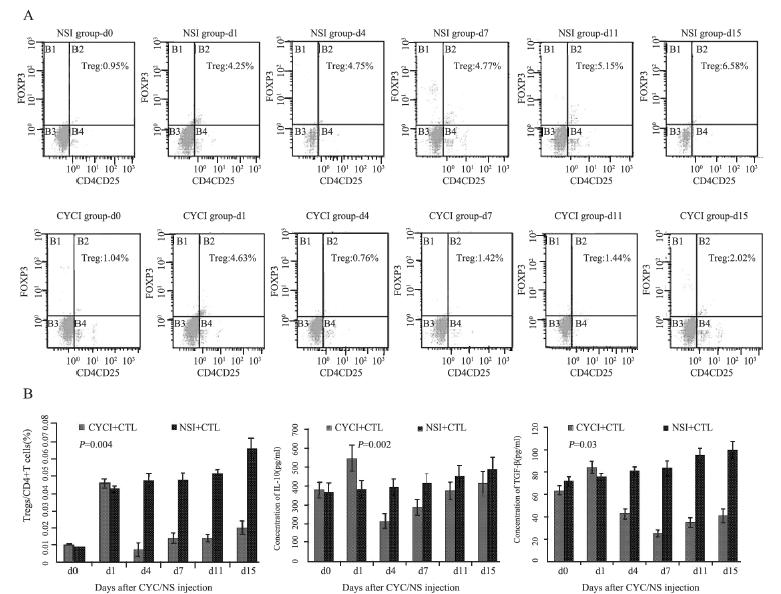
|
| A: Flow cytometry charts of Tregs in tumors at the different time points after CYC or the solution of 0.9% w/v of NaCl injection between CYCI+CTL group and NSI+CTL group; B: Comparison of the levels of Treg,IL-10 and TGF-β in tumors at the different time points after CYC or NS injection between the two groups; CYC: cyclophosphamide; CYCI: cyclophosphamide injection; NSI: the solution of 0.9% w/v of NaCl 图 2 CYCI+CTL和NSI+CTL两组CYC/0.9%NaCl溶液应用后各时间点Treg、IL-10、TGF-β水平比较 Figure 2 Comparison of Treg,IL-10 and TGF-β levels at the different time points after CYC or the solution of 0.9% w/v of NaCl injection between CYCI+CTL group and NSI+CTL group |
CTL回输后6h~d1,两组均显示肿瘤组织中 较多的CFSE-CTL聚集。d3~d15,两组间CTL分 布模式出现差异:CYCI+CTL组肿瘤内表现为较 多的CFSE-CTL聚集分布,且持续时间较长,达 6~10天;而NSI+CTL组肿瘤组织,则表现为较少 的CFSE-CTL分布聚集,持续时间短,3天之后迅 速减少。d21,NSI+CTL组肿瘤组织中CFSE-CTL 几乎消失;而CYCI+CTL组,肿瘤组织中仍可见到 CFSE-CTL分布。统计分析显示肿瘤组织中CFSECTL 阳性细胞比例在CYCI+CTL组比NSI+CTL组明 显增多,且富集时间较长(P=0.009),见图 3A、3B。
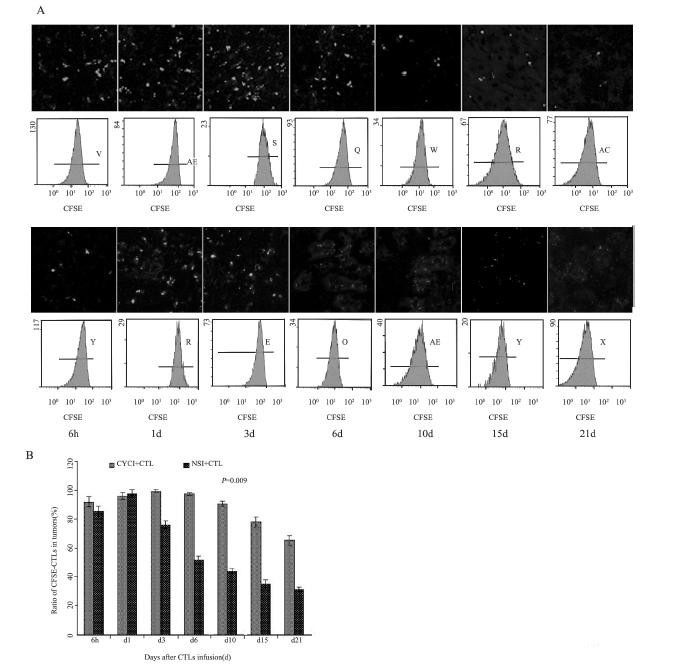
|
| A: Comparison of morphological distribution of CFSE-CTLs in tumors between CYCI+CTL group (up) and NSI+CTL group (down) (LSCM ×100); B: Comparison of CFSE-CTLs ratio in tumors between the two groups 图 3 CYCI+CTL和NSI+CTL两组回输的CFSE-CTLs肿瘤内归巢分布比较 Figure 3 Comparison of transfused CFSE-CTLs homing between CYCI+CTL group and NSI+CTL group |
计算各组不同时间点肿瘤体积并进行比较。 采用重复测量方差分析显示:CYCI组和对照组之 间差异无统计学意义(P=0.648);其余各组之 间差异均有统计学意义(P<0.05);NSI+CTL组 和CYCI+CTL组相比,免疫治疗早期,两组间肿 瘤体积差异无统计学意义(P>0.05),自回输后 第3天始,两组间肿瘤体积差异均有统计学意义 (P<0.001),肿瘤抑制效果差异自CTL回输后第 6~15天尤为显著,见图 4。
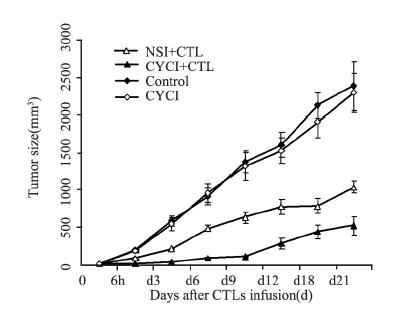
|
| 图 4 CTLs回输后各组抗肿瘤效果比较 Figure 4 Comparison of anti-tumor effect after CTLs infusion among every group |
肿瘤微环境中复杂多变的免疫抑制网络限制 了肿瘤过继性免疫治疗的实际效果,其中的免疫 抑制因素是困扰免疫治疗的关键。近年来随着肿 瘤免疫基础研究的发展,虽然仍未完整阐明肿瘤 的免疫抑制网络,但其中重要节点-Treg细胞和细 胞因子TGF-β、IL-10的作用日益受到重视[5, 6]。
肿瘤微环境Treg比例增加,导致肿瘤免疫失 调,去除这群细胞可有效诱导肿瘤免疫[5]。动物实 验表明,肿瘤微环境中激活的TGF-β诱导的免疫 抑制是保护肿瘤细胞逃脱机体免疫系统监视的最重要因素,TGF-β是肿瘤免疫逃逸的最主要调控 者[7]。而当机体发生肿瘤时,IL-10水平会异常升 高。Treg可通过分泌TGF-β、IL-10等因子抑制效应 T细胞和DC功能[8]。TGF-β可诱导Treg扩增,而扩 增的Treg又可进一步分泌TGF-β[8]。可见,Treg、 TGF-β和IL-10在肿瘤微环境中相互影响和作用, 诱导了肿瘤的免疫耐受。而寻找消除这些免疫抑 制因素的新方法,成为肿瘤免疫治疗领域研究的 重要课题。
已有报道低剂量CYC能降低和抑制正常小 鼠Treg细胞数目和功能,其机制可能是通过抑制 Treg增殖并且增强其凋亡敏感度而实现的[9]。因 为Treg、TGF-β和IL-10这三种免疫抑制因素的密 切关联作用,低剂量CYC有可能抑制Treg同时, 对肿瘤微环境中的TGF-β和IL-10水平也会产生影 响,从而有可能打破肿瘤免疫耐受,调控效应细 胞在瘤体内的存留分布和功能效应。本实验中利 用低剂量CYC腹腔注射,发现在降低荷瘤小鼠体 内Treg同时,TGF-β和IL-10水平也同时下降。分 析其原因,可能是小剂量CYC引致体内Treg水平 下降,后者会导致TGF-β、IL-10的分泌下降,另 一方面,Treg水平下降又会破坏肿瘤免疫抑制, 引致肿瘤产生IL-10下降;而IL-10下降又能导致无 能T细胞产生TGF-β下降。因此出现Treg、IL-10和 TGF-β水平的同时下降,从而破坏了肿瘤免疫耐 受,以利于回输的CTL充分发挥其杀伤效应。进一步研究发现,Treg和IL-10在注射后第4天降低最 明显,而TGF-β则较为延迟,于用药后第7天降低 较明显,这就提示低剂量CYC提前应用提供了免 疫治疗的最佳“窗口期”,即CYC干扰微环境后4~7 天实施CTL回输治疗,治疗效果应当最佳。
过继免疫治疗细胞经外周静脉途径输注后在 活体内分布迁徙规律的研究,目前主要集中在细 胞可以分布的器官、可否归巢于淋巴循环以及是 否对肿瘤组织选择性富集[10]。本研究发现,CYC 干扰微环境组较对照组回输的CTL在肿瘤组织中 归巢聚集明显且存留时间长,低剂量CYC可以明 显改善效应细胞在肿瘤内的存留分布。
但是实验中发现单纯的低剂量CYC应用并不 能产生明显地抑瘤作用,还需要抗原特异性效应 细胞CTL的回输才能发挥有效作用。在利用低剂 量CYC干扰肿瘤免疫微环境,摆脱免疫耐受的基 础上,回输的CTL对肿瘤的杀伤效率才得以明显 提高,肿瘤体积生长明显减缓,这种趋势愈近治 疗后期愈明显。当然,CTL回输体内后对肿瘤的 杀伤作用十分复杂,诸如各种杀伤介质的蛋白表 达水平变化,肿瘤细胞的凋亡坏死等,因此其具 体机制还需要进一步深入研究。
| [1] | Kaluza KM, Vile R. Improving the outcome of adoptive celltransfer by targeting tumor escape[J]. Oncoimmunology, 2013,2(1): e22059. |
| [2] | Bellone M, Calcinotto A, Filipazzi P, et al. The acidity of the tumor microenvironment is a mechanism of immune escape that can beovercome by proton pump inhibitors[J]. Oncoimmunology, 2013,2(1): e22058. |
| [3] | Song Y, Zhu XK.Current progress of the mechanism of tumorimmune escape[J].Xian Dai Zhong Liu Yi Xue,2011,19 (6):1230-4.[宋彦, 朱喜科. 肿瘤免疫逃逸机制的研究新进展[J].现代肿瘤医学, 2011, 19(6): 1230-4.] |
| [4] | Sharabi A,Haran -GheraN. Immune recovery afte rcyclophosphamide treatment in multiple myeloma: implication formaintenance immunotherapy[J]. Bone Marrow Res, 2011, 2011:269519. |
| [5] | Singer BD, King LS, D‘Alessio FR. Regulatory T cells asimmunotherapy[J]. Front Immunol, 2014, 5: 46. |
| [6] | Hiraki S, Ono S, Tsujimoto H, et al. Neutralization ofinterleukin-10 or transforming growth factor-β decreases thepercentages of CD4+CD25+Foxp3+ regulatory T cells in septicmice, thereby leading to an improved survival[J]. Surgery, 2012,151(2): 313-22. |
| [7] | Perrot CY, Javelaud D, Mauviel A. Insights into the transforming growth factor-β signaling pathway in cutaneous melanoma[J].Ann Dermatol, 2013, 25(2): 135-44. |
| [8] | Peterson RA. Regulatory T-cells: diverse phenotypes integral toimmune homeostasis and suppression[J]. Toxicol Pathol, 2012,40(2):186-204. |
| [9] | Heylmann D, Bauer M, Becker H, et al. Human CD4+CD25+regulatory T cells are sensitive to low dose cyclophosphamide:implications for the immune response[J]. PLoS One, 2013, 8(12):e83384. |
| [10] | Wu ZY, Du XH, Xu YX, et al. Evaluation of in vivo labeledcytotoxic T lymphocytes and cytokine-induced killer cellsmigration and distribution of subcutaneous gastric tumor model innude mice[J]. Zhonghua Yi Xue Za Zhi, 2010, 90(6): 403-6.[武增瀛, 杜晓辉, 徐迎新,等. 细胞毒性T淋巴细胞和细胞因子诱导杀伤细胞在荷人胃癌裸鼠体内的迁徙与分布[J]. 中华医学杂志,2010, 90(6): 403-6.] |
 2014, Vol. 41
2014, Vol. 41
