文章信息
- 刘春安, 许庆文, 何可, 徐飞鹏, 林琳, 黄哲, 周才进, 朱文劲, 王玮尉, 鲁珏. 2014.
- LIU Chun'an, XU Qingwen, HE Ke, XU Feipeng, LIN Lin, HUANG Zhe, ZHOU Caijin, ZHU Wenjin, WANG Weiwei, LU Jue. 2014.
- n-3多不饱和脂肪酸灌胃对大鼠结直肠癌的预防作用
- Preventive Effect of n-3 Polyunsaturated Fatty Acids Intragastric Administration on Rats Colorectal Cancer
- 肿瘤防治研究, 2014, 41(12): 1279-1281
- Cancer Research on Prevention and Treatment, 2014, 41 (12): 1279-1281
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.12.005
-
文章历史
- 收稿日期:2013-10-10
- 修回日期:2014-04-14
结直肠癌是主要的恶性肿瘤之一,确诊时往往已处于中晚期,尽管诊疗技术取得了很大的进展,但5年生存率低于30%[1]。流行病学调查结果显示n-3多不饱和脂肪酸(n-3PUFAs)可减少肿瘤的发病率。本研究前瞻性观察n-3PUFAs灌胃对N-甲基-N-亚硝基脲(MNU)灌肠诱导大鼠结直肠癌的影响。 1 材料与方法 1.1 实验动物及材料
选取6周龄健康S P F级别的S D大鼠共6 0只(购买于广东医学院实验动物中心),体质量150~180g,实验组和对照组分别30只,雌雄各半,分笼饲养于普通环境,适应两周后开始实验。MNU购于美国Sigma公司,n-3PUFAs购于北京百慧生化制药责任有限公司,16种脂肪酸甲酯类(FAME)混标购于美国Supelco公司。1.2 实验方法及观察指标1.2.1 大鼠结直肠癌模型的建立
参照唐茂盛等[2]方法建立大鼠结直肠癌模型,将导尿管截下约7~8 cm,与10 ml的注射器相连,在距导尿管尖端6 cm处做标记,每只大鼠用固定的导尿管灌肠,导尿管尖端用石蜡油润滑,以便顺利插入肠道并有效减少大鼠在灌肠时的挣扎,每次灌注前提起大鼠尾部以刺激大鼠排尽大便,减少大便对灌肠过程的干扰,灌注结束后要按住肛门约1 min防止液体过早的排出体外。两组均用4 mg/ml浓度的MNU溶液进行灌肠,每次灌注剂量为2 mg/100 g,插入深度为6 cm,灌肠频率为开始3次/周,持续4周,以后持续以1次/周至16周。实验组同时予n-3PUFAs灌胃[0.1 g/(100g•d),稀释成1.5 ml],对照组用等量的0.9%氯化钠溶液灌胃,均用灌胃针进行灌胃,灌胃深度约5 cm,灌胃时大鼠口腔与食管呈一直线,一定要沿着口角进针,再顺着食管方向插入胃内,避免插入气管内。两组均喂养大小鼠生长用饲料(80 g/d),自由饮水。1.2.2 观察大鼠一般情况
包括第16周大鼠的大便、体质量、饮食等。1.2.3 标本收集
处死大鼠前禁食12 h,先从心脏抽取血液约3 ml,离心后保存备用。仔细解剖大鼠结直肠,寻找隆起组织,观察淋巴结及远处转移情况。1.2.4 n-3PUFAs测定
取离心分离出的红细胞1 ml,采用气相色谱方法进行测定。1.2.5 病理组织学检查
将可疑组织进行HE染色,常规病理学检查。1.3 统计学方法
采用SPSS17.0统计软件,计量资料以均数±标准差表示,采用独立样本t检验,计数资料的比较采用卡方检验,P<0.05表示差异有统计学意义。2 结果2.1 两组大鼠红细胞n-3PUFAs的浓度
对照组大鼠红细胞n-3PUFAs浓度为(3.38±0.81)µg/ml,实验组大鼠红细胞n-3PUFAs浓度为(8.39±1.79)µg/ml,差异有统计学意义(P<0.01)。2.2 一般情况2.2.1 大便改变
第16周时,两组大鼠均有大便改变(大便变细或不成形),实验组5只出现便血,对照组13只出现便血(P<0.05),差异有统计学意义。2.2.2 饮食改变
第16周两组大鼠的每日食物消耗量均较前下降,实验组每日饮食量为(66.6±9.2)g,对照组为(58.0±12.5)g (P<0.01),差异有统计学意义。2.2.3 体质量改变
灌肠前两组体质量无显著差异。灌肠至16周时对照组大鼠体质量为(295.85±42.92)g和实验组(345.75±35.11)g (P<0.01),差异有统计学意义。2.3 两组大鼠解剖观察
对照组大鼠26只在距肛门约2~9 cm处可见局部隆起肿物,其余4只未见;发现肿瘤的大鼠中17例为单发、9例为多发,最大直径10 mm;多发肿瘤的大鼠中只有1例侵犯肠系膜,均未见明显远处转移。
实验组大鼠19只在距肛门约4~9 cm处可见隆起肿物,其余11只未见;发现肿瘤的大鼠中15例为单发、4例为多发,肿物的最大直径约5 mm,均未见与周围组织粘连及远处转移,见图 1。
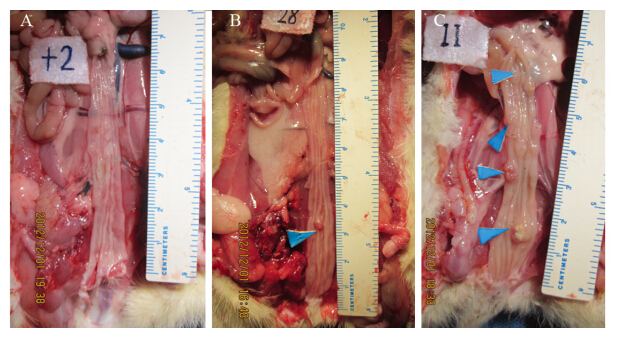
|
| A: normal colonic mucosa; B: single colonic tumor; C: multiple colonic tumor 图 1 正常结肠黏膜及造模后大肠肿瘤 Figure 1 Normal colonic mucosa and colonic tumor after modeling |
两组大鼠肿瘤采用HE染色,病理结果均为腺癌。对照组肿瘤发生率为86.67%(26/30),实验组的肿瘤发生率为63.33%(19/30),两组的肿瘤发生率差异有统计学意义(P<0.05),见图 2。

|
| A: normal colonic mucosa (×40); B: colonic atypical hyperplasia (×200); C: colonic adenocarcinoma (×200) 图 2 实验组和对照组大鼠的结肠黏膜病理学特征 Figure 2 Pathological examination of colonic mucosa in experimental and control groups |
成熟红细胞内没有线粒体,缺乏从头合成脂肪酸的能力,红细胞膜脂肪酸组成的变化很大程度上是与血浆或其他组织长期进行脂肪酸交换的结果,能够反映其他组织脂肪酸代谢的情况。本实验通过气相色谱方法测定大鼠红细胞膜内n-3PUFAs浓度来评估大鼠n-3PUFAs灌胃后的效果,结果两组大鼠红细胞膜n-3PUFAs差异显著,因此认为通过口服n-3PUFAs能够提高大鼠体内n-3PUFAs的浓度。
目前结直肠癌动物模型的建立,常用的方法有裸鼠皮下注射、腹腔注射、原位结肠接种,这些方法不贴近结肠癌的自然发生、发展过程。本研究应用MNU对SD大鼠进行灌肠,肿瘤的发生率高(86.67%),而且贴近结肠癌的自然发生、发展过程,可为探讨结直肠癌原位生长及淋巴道转移机制寻找新的治疗方案以及抗转移治疗等提供理想的动物模型。
排便习惯改变与大便性状的改变往往是结直肠癌最早出现的临床症状,多表现为:腹泻、大便次数增多、血便、黏液便等。本实验示:灌肠至第16周时两组大鼠均发生大便性状的改变,对照组出现便血大鼠多于研究组(13 vs.5),差异有统计学意义(P=0.024)。笔者认为大便性状改变可能与MNU灌肠导致大鼠的肠道黏膜发生病理性改变或与灌肠刺激作用有关,血便可能为大鼠结直肠癌破溃出血所致。
灌肠至第16周时,对照组大鼠进食少于实验组,对照组体重明显低于实验组,差异有统计学意义(P<0.01),因此认为两组体重的差异可能与饮食、吸收功能和肿瘤慢性消耗等的差异有关。
本研究解剖大鼠及组织病理学发现,对照组大鼠肿瘤发生率为86.67%,而实验组为66.67%,差异有统计学意义(P<0.05),提示n-3PUFAs对大鼠结直肠肿瘤的发生具有抑制作用。
对照组的结直肠肿瘤发生率和有关文献报道相近[2],但本实验对照组只有1例大鼠肿瘤侵犯肠系膜,其余无明显的淋巴结及远处转移,明显低于文献报道[2]的淋巴结及全身转移率,具体原因不清楚,可能与SD大鼠的免疫功能和诱导时间有关,延长灌肠时间可能会出现更多淋巴结及远处转移,但笔者认为本实验结果可能更贴近大鼠结直肠癌缓慢发生、发展的特点。
关于n-3PUFAs抗肿瘤作用的机制非常复杂,到目前为止还不十分清楚。Rogers等[3]认为n-3PUFAs是通过细胞膜脂肪成分,增加肿瘤细胞膜的流动性,诱导细胞凋亡,从而减少结肠细胞癌变;Hurst等[4]发现n-3PUFAs能够通过减少NO,减少COX-2的mRNA和蛋白表达水平,从而抑制肿瘤细胞的侵入、生长、转移。Girroir等[5]认为n-3PUFAs通过提高PPARbeta/delta配体的表达,从而抑制肿瘤细胞的增殖。Hull[6]认为n-3PUFAs是通过其抗炎作用来预防结直肠肿瘤形成的。综合文献,笔者认为n-3 PUFA对肿瘤生长的影响机制,尚侧重于对细胞或组织脂肪酸组成变化的影响及细胞基本结构和凋亡通路的影响,尚无明确的相关分子机制说明。本实验结果示n-3 PUFA具有抑制大鼠结直肠的发生、发展,可能与其改善大鼠的一般情况有关,具体机制仍需进一步探索。
因此,n-3PUFAs灌胃能够改善大鼠的一般情况,减少MNU灌肠诱导大鼠结直肠癌的发生率,可能机制仍需进一步研究。
| [1] | Stillwell AP, Buettner PG, Sin SK, et a1. Predictors of postoperative mortality, morbidity, and long-term survival after palliative resection in patients with colorectal cancer[J]. Dis Colon Rectum, 2011, 54(5): 535-44. |
| [2] | Tang MS, Hu ZQ, Wang WJ, et a1. Establishment of orthotopic colon tumor and metastasis model by coloclysis of mnu in rat[J]. Shi Yan Dong Wu Yu Bi Jiao Yi xue, 2010, 30(1): 12-5. [唐茂盛, 胡志前, 王伟军, 等. NU灌肠诱导大鼠原位结肠癌及远处转移的模型建立[J].实验动物与比较医学, 2010, 30(1): 12-5.] |
| [3] | Rogers KR, Kikawa KD, Mouradian M, et a1. Docosahexaenoic acid alters epidermal growth factor receptor-related signaling by disrupting its lipid raft association[J]. Carcinogenesis, 2010, 31(9): 1523-30. |
| [4] | Hurst S, Rees SG, Randerson PF, et a1. Contrasting effects of n-3 and n-6 fatty acids on cyclooxygenase-2 in model systems for arthritis[J]. Lipids, 2009, 44(10): 889-96. |
| [5] | Girroir EE, Hollingshead HE, Billin AN, et a1. Peroxisome proliferator-activated receptor-beta/delta(PPARbeta/delta) ligands inhibit growth of UACC903 and MCF7 human cancer cell lines[J]. Toxicology, 2008:243(1-2): 236-43. |
| [6] | Hull MA. Nutritional agents with anti-inflammatory properties in chemoprevention of colorectal neoplasia[J]. Recent Results Cancer Res, 2013, 191: 143-56. |
 2014, Vol. 41
2014, Vol. 41


