文章信息
- 张广钰,钟漓,王振冉,朱袭嘉,董陈诚,冉福林. 2014.
- ZHANG Guangyu, ZHONG Li, WANG Zhenran, ZHU Xijia, DONG Chencheng, RAN Fulin. 2014.
- 沉默ABCC4基因逆转人胃癌多药耐药的研究
- Silencing ABCC4 Gene Reverses Multi-drug Resistance of Human Gastric Cancer Cells
- 肿瘤防治研究, 2014, 41(12): 1271-1275
- Cancer Research on Prevention and Treatment, 2014, 41 (12): 1271-1275
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.12.003
-
文章历史
- 收稿日期:2014-03-04
- 修回日期:2014-05-20
胃癌是最为常见的恶性肿瘤之一,其致死率 占全世界癌症死亡率的10%以上,是癌症导致死 亡的第二个最常见原因[1]。目前胃癌最常用的治疗 方法是手术、放疗和化疗,以及根据不同病程的 综合治疗,而化疗是目前治疗胃癌的重要手段之 一,但由于胃癌细胞容易对化疗药物产生多药耐 药性,所以常常导致胃癌化疗的效果很不理想。
胃癌多药耐药产生的分子机制有多种,研究 表明ABCC4蛋白的异常表达可能与胃癌多耐药关 系密切,因此,本课题主要阐述ABCC4基因对胃 癌多药耐药的发生及进展的影响。
1 材料和方法 1.1 细胞、抗体及试剂人胃黏膜上皮细胞GE S - 1 、人胃癌细胞 MGC-803、人胃腺癌细胞SGC-7901及多药耐药 细胞SGC-7901/Fu均购自美国ATCC。ABCC4、 P-gp、Bax、Bcl-2、CDK4和Cyclin D1抗体均购 自Abcam公司(美国),PI购自Sigma公司(美 国),siRNA由GenePharma公司(上海)合成, RT-PCR试剂盒(TaKaRa RNA PCR Kit(AMV) Ver.3.0)购自宝生物有限公司。
1.2 细胞培养人胃黏膜上皮细胞GE S - 1 、人胃癌细胞 MGC-803、人胃腺癌细胞SGC-7901用含10%胎牛 血清、100 u/ml青霉素和100 μg/ml链霉素的RPMI 1640培养液,于37℃、5% CO2的培养箱中进行培 养。SGC-7901/Fu细胞需要在上述培养液中加入20 μg/ml 5-Fu,以维持细胞的耐药性。待细胞长至对数生长期进行实验。
1.3 细胞活力检测将SGC-7901/Fu细胞接种于96孔培养板中,待细 胞生长至对数期。每孔加入20 μl MTT (0.5 mg/ml), 于37℃条件下孵育4 h,待黄色染液转变成蓝色结 晶后,除去培养液,每孔加入150 μl DMSO,使蓝 色结晶充分溶解。酶联免疫检测仪在490 nm处检测 各孔的吸光度A值(A490 nm)。实验设24、48、72、 96、120 h五个时间组,每组设8个平行孔。
1.4 细胞转染将细胞常规接种于6孔培养板中,待细胞长至 70%融合度后进行转染。实验设SGC-7901/Fu细胞 组(Control组)、转染空质粒组(N-control组)和 ABCC4基因沉默组(RNAi组)。更换不含血清及 双抗的RPMI 1640培养液,加入1.5×109 TU/ml病毒 4 μl进行转染(靶向人ABCC4基因的RNAi重组慢 病毒载体LV-shRNA-ABCC4为本实验室在前期工 作中构建),并向各孔加入聚凝胺(Polybrene)。 病毒感染12 h后,更换含有10%胎牛血清的RPMI 1640培养液继续培养。RNA干扰效率用RT-PCR和 Western blot进行检测。
1.5 RNA提取和RT-PCR检测提取各组细胞总R N A ,提取步骤参照 RNAisoTM Plus(TaKaRa,日本) 说明书。 计算浓度后,使用RT-PCR试剂盒(TaKaRa, 日本)进行RT-PCR反应,步骤参照说明书。 ABCC4、MDR1、β-actin引物由Invitrogen公司 合成。ABCC4上游引物:5'-CGCGTGTTCTT CTGGTGGCTC-3',下游引物:5'-CTTTATC CCAGAACCCTTGC-3';MDR1上游引物:5'- CCCATCATTGCAATAGCAGG-3',下游引物: 5'-GTTCAAACTTCTGCTCCTGA-3';β-actin上游 引物:5'-CTGGGACGACATGGAGAAAA-3',下 游引物:5'-AAGGAAGGCTGGAAGAGTGC-3'。 PCR反应体系50 μl,反应条件:94℃ 2 min,94℃ 变性30 s,61℃退火30 s,72℃延伸30 s,共30个 循环。得到的PCR产物用1.2%琼脂糖凝胶电泳, 并使用凝胶成像系统进行扫描分析。
1.6 细胞凋亡检测收集各组细胞并制备成单细胞悬液。按照凋 亡试剂盒(Annexin-V-FITC Kit,BD公司,美 国) 说明书步骤,分别加入Annexin-V和PI,室温 避光染色20 min,流式细胞仪(Becton-Dickinson, USA)进行检测。
1.7 细胞周期检测收集各组细胞并制备成单细胞悬液。70%的冷 乙醇4℃固定过夜。加入1 ml PI染液(含RNase 10 μg,Triton X-100 5 μl),4℃避光染色30 min,流式细胞仪(Becton-Dickinson,USA)检测细胞周期。
1.8 Caspase活力测定收集各组细胞,按Caspase活力检测试剂盒 (碧云天公司,中国)的操作方法测定Caspase-3, Caspase-8,Caspase-9的活力。用荧光分光光度计 在激发波长400 nm,发身波长505 nm下进行测定。
1.9 Western blot检测分析收集实验各组细胞,加入2 ml细胞裂解液(50 mM Tris-HCl,137 mM氯化钠,10% 甘油,100 mM 钒酸钠,1 mM PMSF,10 mg/mL抑肽酶, 10 mg/ml亮肽素,1% NP-40,5mM cocktail;pH 7.4)裂解细胞。BCA法测定蛋白质浓度。每孔加 入等量蛋白质,进行SDS-PAGE。半干法进行转 膜,封闭过夜。洗膜后加入一抗孵育2 h,TBST洗 膜,加入二抗孵育2 h。加入化学发光试剂,X片 曝光显像,扫描条带,并进行灰度分析。
1.10 裸鼠接种动物实验方案获得桂林医学院医学伦理学委 员会通过。裸鼠购于桂林医学院动物实验中心, 共20只,雄性,6~8周龄,体重约25 g。随机分成 2组,每组10只,分别在皮下注射N-Control组及 RNAi组细胞。每只注射5×105个细胞,每日观察裸 鼠生长情况。4周后颈椎法处死裸鼠,无菌条件下 切取皮下移植瘤组织进行检测。
1.11 统计学方法采用SPSS16.0软件进行统计学处理。全部数 据均以均数±标准差(x±s)表示,各实验组间比 较采用单因素方差分析和LSD-t检验。P<0.05为差 异有统计学意义。
2 结果 2.1 ABCC4基因在胃癌多药耐药SGC-7901/Fu细 胞中高度表达实验发现,ABCC4 mRNA在MGC-803细 胞,SGC-7901细胞和SGC-7901/Fu细胞中的表 达水平均高于GES-1细胞,差异有统计学意义 (P<0.05),特别是以SGC-7901/Fu细胞中的 ABCC4 mRNA表达水平增高最为显著。同时, Western blot分析ABCC4蛋白在上述4种细胞中的表 达水平与ABCC4 mRNA的表达水平基本一致。结 果说明,人胃癌多药耐药SGC-7901/Fu细胞中存在 高水平的ABCC4基因和蛋白表达 ,见图 1。
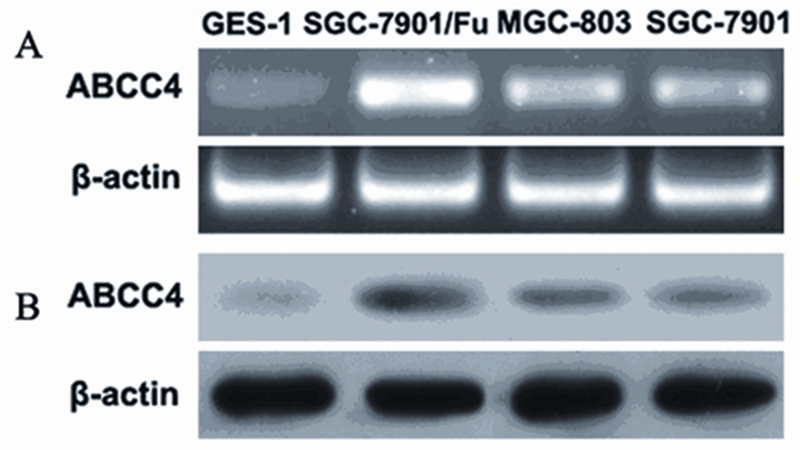
|
| A: the expression level of ABCC4 gene in 4 cells by RT-PCR; B: the expression level of ABCC4 protein in 4 cells by Western blot 图 1 ABCC4 在GES - 1 、MGC- 8 0 3 、SGC- 7 9 0 1 及 SGC-7901/Fu细胞中的表达 Figure 1 ABCC4 expression in GES-1,MGC-803, SGC-7901 and SGC-7901/Fu cells |
实验发现,感染4天后,ABCC4 mRNA表达水 平与对照组和N-Control组相比显著下调,同时, ABCC4蛋白表达水平也会显著下调 ,差异有统计 学意义(P<0.05),见图 2。
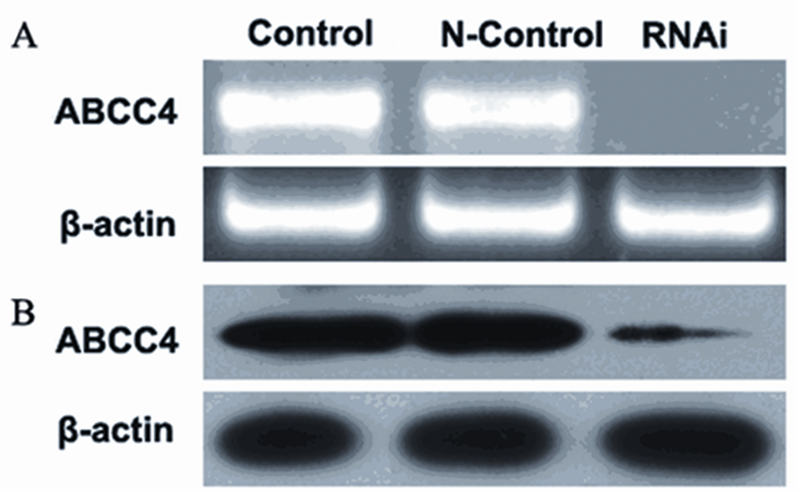
|
| A: the expression level of ABCC4 gene in SGC-7901/Fu cells that was silenced by RNA interference; B: the expression level of ABCC4 protein by Western blot 图 2 RNA干扰沉默SGC-7901/Fu细胞中ABCC4的表达 Figure 2 ABCC4 expression in SGC-7901/Fu cells silenced by RNA interference |
流式细胞仪分析结果发现,RNA干扰沉默 ABCC4基因,给予5-Fu治疗后SGC-7901/Fu细胞 的凋亡率较其他各治疗组明显增高,见图 3A。 Caspase-3及Caspase-9表达水平也明显增加,见图 3B。此外,Western blot分析结果发现,Bax蛋白 表达显著增加,而Bcl-2蛋白表达降低,见图 3C、3D。这些结果证实,沉默ABCC4基因可以增强 5-Fu诱导SGC-7901/Fu细胞发生凋亡的能力。
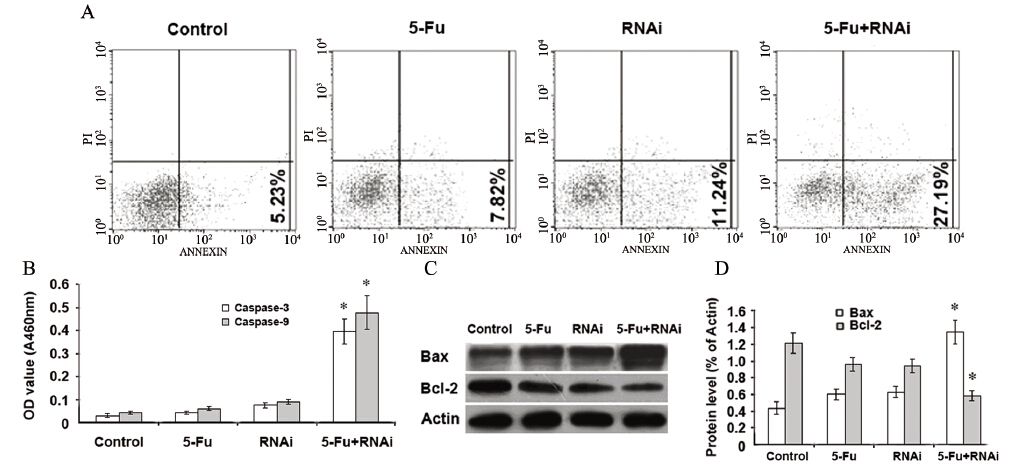
|
| A: SGC-7901/Fu cell apoptosis detected by flow cytometry; B: detection of Caspase-3 and Caspase-9 activity; C,D: the expression levels of Bax and Bcl-2 protein detected by Western blot in SGC-7901/Fu cell after silencing ABCC4; *:P<0.05,means 5-Fu+RNAi group was statistically significant difference than other groups 图 3 沉默ABCC4基因增强5-Fu诱导胃癌多药耐药SGC-7901/Fu细胞凋亡 Figure 3 Silencing ABCC4 gene enhanced the apoptosis of SGC-7901/Fu cells |
流式细胞仪对细胞周期的检测结果发现, 单独给予5-Fu或RNA干扰治疗并不能改变细胞周 期的分布状态。然而,当沉默ABCC4基因的同 时给予治疗剂量的5-Fu则会使被阻滞在G1期内的 SGC-7901/Fu细胞数量显著增加,见图 4A。同时, 进一步检测细胞周期蛋白Cyclin D1和CDK4的表达 水平,经Western blot分析发现,5-Fu+RNAi组的 Cyclin D1和CDK4蛋白表达水平显著降低,见图 4B、4C。Cyclin D1和CDK4蛋白在G1期调控中发 挥着不可替代的作用,研究表明,沉默ABCC4基 因增强5-Fu抑制胃癌多药耐药SGC-7901/Fu细胞增 殖可能是通过下调Cyclin D1和CDK4蛋白表达水 平,从而导致细胞周期被阻滞在G1期而实现的。
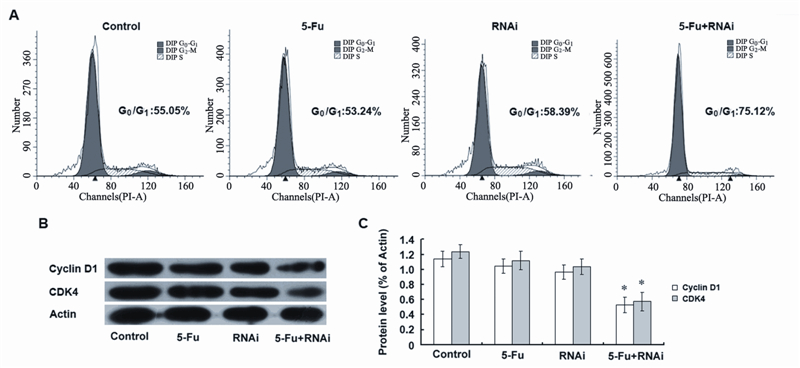
|
| A: cell cycle changes detected by flow cytometry; B,C: the expression levels of cycle protein Cyclin D1 and CDK4; *:P<0.05,means 5-Fu + RNAi group was statiscally significant difference than other groups 图 4 沉默ABCC4基因增强5-Fu诱导胃癌多药耐药SGC-7901/Fu细胞周期阻滞 Figure 4 Silencing ABCC4 gene enhanced SGC-7901/Fu cell cycle arrest |
动物实验方案获得桂林医学院附属医院伦 理委员会讨论通过。常规建立裸鼠皮下移植瘤 模型,并分组给予ABCC4基因RNA干扰试剂和 5-Fu。发现在任何时间段,5-Fu+RNAi组的肿瘤体 积均显著小于N-Control组。同时,手术切取肿瘤 的重量在5-Fu+RNAi组也显著小于N-Control组, 见图 5。本研究结果提示沉默ABCC4基因在体内也 能明显逆转人胃癌多药耐药性。
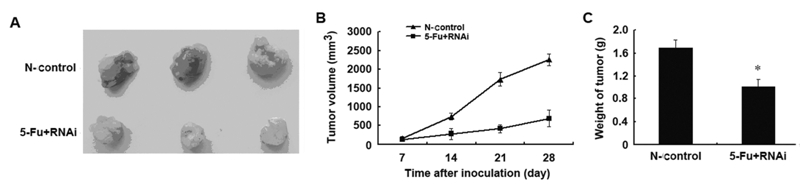
|
| A: tumor tissues from operation resection after inoculated for 29 days; B: tumor volume measured at different time pointes after inoculation; C: the tumor weight of two groups after inoculated for 29 days; *: P<0.05,compared with N-control group 图 5 沉默ABCC4基因抑制裸鼠移植瘤生长 Figure 5 Silencing ABCC4 gene inhibited the growth of transplanted tumor in nude mice |
P-gp(MDR1)转运蛋白水平的检测结果发 现,沉默ABCC4基因后MDR1基因的表达水平随之下降,并且P-gp转运蛋白的表达水平也随之降 低,差异有统计学意义(P<0.05),见图 6。本 研究结果说明沉默ABCC4基因增加胃癌多药耐药 SGC-7901/Fu细胞对5-Fu的化疗敏感度可能与下调 P-gp(MDR1)转运蛋白相关。
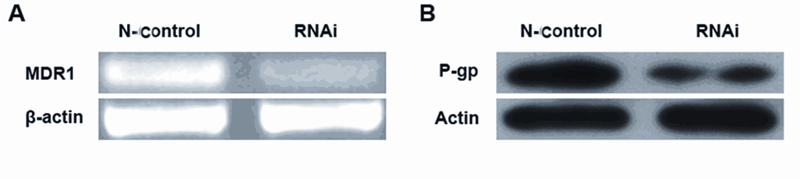
|
| A: MDR1 gene expression level detected by RT-PCR; B:The expression level of P-gp protein detected by Western blot 图 6 沉默ABCC4基因通过MDR1逆转胃癌多药耐药 SGC-7901/Fu细胞对5-Fu的敏感度 Figure 6 Silencing ABCC4 gene reversed the sensitivity of SGC-7901/Fu to 5-Fu by MDR1 |
ABC转运蛋白家族4(ABCC4)是ABC 转 运蛋白家族成员,又称多药耐药相关蛋白4 (MRP4)。ABCC4最先被发现于前列腺上皮细胞 的基底膜。ABCC4在人类中定位于染色体13q32, 全长约312 kb,含有31个外显子,编码1 325个氨 基酸[2],是耐药基因家族成员之一。ABCC4的结 构具有一定的特异性,它缺失N端的一个跨膜结 构域,形成MSD1-NBD1-MSD2-NBD2的结构, 是ABC家族中结构最简单的蛋白。ABCC4能向 胞外转运多种结构不同的内源性和外源性有机阴 离子,ABCC4的这种特性赋予细胞耐受细胞毒性 复合物,保护重要组织免受异型生物质侵害的功 能,同时也影响细胞中药物的代谢,从而产生抗 药性。
近年来ABCC4与肿瘤的关系已成为研究的热 点,Dong和Cai等[3, 4]发现ABCC4在通过雄激素诱 导的前列腺癌细胞中高表达,随后的研究进一步 证实了ABCC4 mRNA在前列腺癌中过度拷贝[5]。 本研究发现ABCC4基因及蛋白在多种人胃癌细胞 以及胃癌耐药细胞中表达水平升高,特别是在人 胃癌耐药细胞中的表达水平升高最为显著。这意 味着ABCC4与人胃癌耐药的发生发展过程有着某 种密切的联系,很可能是一个潜在的胃癌耐药的 治疗靶点。为了进一步阐明ABCC4是否与人胃癌 耐药的发生发展存在关联及其详细作用机制,本 研究结果发现,下调ABCC4后人胃癌耐药细胞增 殖受到抑制,细胞发生凋亡,细胞周期被阻滞在 G0/G1期以内。同时,裸鼠体内的移植瘤生长受到 抑制。上述现象说明ABCC4在人胃癌耐药细胞中 的高表达状态促进了肿瘤细胞的增殖。既往的研 究也表明,ABCC4的高表达对胰腺癌、卵巢癌等 恶性肿瘤均具有促进作用。这充分证明了ABCC4 在人胃癌耐药细胞的增殖过程中同样发挥了重要的调控作用。
然而,至今为止,尚不清楚ABCC4是如何调 控人胃癌耐药细胞增殖抑制过程的。随后本研究 从细胞凋亡和细胞周期进程等方面进行了探讨, 发现通过下调ABCC4可导致人胃癌耐药细胞发生 凋亡,而Dai等[6]研究发现,ABCC4可通过调控 mTOR信号转导通路从而调控细胞凋亡。这些结 果与本研究较为一致。而进一步的研究发现,下 调ABCC4抑制人胃癌耐药细胞增殖与细胞发生凋 亡密切相关。同时,下调ABCC4可将人胃癌耐药 细胞周期阻滞在G0/G1期以内。上述现象说明, ABCC4在人胃癌耐药细胞中的高表达水平是肿瘤 细胞增殖所必需的,若下调ABCC4可导致人胃癌 耐药细胞增殖抑制。
既往大量研究证实,线粒体通路和死亡受体 通路[7]是许多肿瘤细胞发生凋亡的经典途径。Bcl-2 和Bax在线粒体凋亡途径中发挥着关键作用[8, 9]。若 Bax从胞质移位到线粒体膜上,则可改变线粒体膜 的通透性,促进细胞色素C从线粒体释放入进入胞 质,继而启动Caspase家族活化及级联放大作用, 最终导致细胞发生凋亡[10, 11, 12]。在本研究中发现,人 胃癌耐药细胞中下调ABCC4可导致Bax和Bcl-2发生 移位,Caspase-3和Caspase-9表达水平明显升高。推 测,线粒体途径细胞凋亡时,细胞色素C释放进入 胞质内可能产生活化Caspase-9和Caspase-3的生物 学效应,从而在细胞凋亡途径中扮演关键的作用。 上述结果证实,下调ABCC4可诱导人胃癌耐药细 胞发生凋亡,并且可能与线粒体途径密切相关。
目前认为恶性肿瘤耐药的发生与肿瘤细胞膜 上的MDR1基因及P糖蛋白的异常表达增加密切相 关,因此有研究者提出,通过各种方法促进两者 的表达下调,就有可能使肿瘤细胞发生耐药性的 概率降低[13, 14]。不可否认,MDR1基因及P糖蛋白 的异常表达往往与肿瘤细胞耐药性的产生紧密相 连。既往研究表明,应用不同的方法使肿瘤耐药 细胞内的MDR1基因及P糖蛋白表达下调,可抑 制肿瘤细胞的耐药性产生[15]。本研究发现,下调 ABCC4的同时给予治疗剂量的5-氟尿嘧啶能够明 显抑制人胃癌耐药细胞增殖及周期进程,并使裸鼠体内肿瘤细胞的生长受到抑制。同时,肿瘤细 胞膜上的MDR1基因及P糖蛋白的表达水平亦明显 降低。上述结果说明,下调ABCC4可通过改变细 胞膜MDR1和P糖蛋白表达水平从而抑制人胃癌耐 药细胞的增殖。
本研究发现ABCC4在人胃癌耐药细胞中呈高 度表达,下调ABCC4可通过调节Bcl-2/Bax作用于 线粒体途径从而诱导人胃癌耐药细胞发生凋亡, 导致细胞周期发生阻滞,并且能增强胃癌耐药细胞 对5-Fu的敏感度。它在未来可能会成为一种新的治 疗方法,为胃癌耐药的临床治疗提供理论依据。
| [1] | Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002[J]. CA Cancer J Clin, 2005, 55(2): 74-108. |
| [2] | Lamba JK, Adachi M, Sun D, et al. Nonsense mediated decay downregulates conserved alternatively spliced ABCC4 transcripts bearing nonsense codons[J]. Hum Mol Genet,2003, 12(2): 99-109. |
| [3] | Dong Y, Zhang H, Gao AC, et al. Androgen receptor signaling intensity is a key factor in determining the sensitivity of prostate cancer cells to selenium inhibition of growth and cancer-specific biomarkers[J]. Mol Cancer Ther, 2005, 4(7): 1047-55. |
| [4] | Cai C, Omwancha J, Hsieh CL, et al. Androgen induces expression of the multidrug resistance protein gene MRP4 in prostate cancer cells [J]. Prostate Cancer Prostatic Dis, 2007,10(1): 39-45. |
| [5] | Ho LL, Kench JG, Handelsman DJ, et al. Androgen regulation of multidrug resistance-associated protein 4 (MRP4/ABCC4) in prostate cancer[J]. Prostate, 2008, 68(13): 1421-9. |
| [6] | Dai ZJ, Gao J, Kang HF, et al. Targeted inhibition of mammalian target of rapamycin (mTOR) enhances radiosensitivity in pancreatic carcinoma cells[J]. Drug Des Devel Ther,2013,7: 149-59. |
| [7] | Nieminen AI, Partanen JI, Klefstrom J. c-Myc blazing a trail of death: coupling of the mitochondrial and death receptor apoptosis pathways by c-Myc[J]. Cell Cycle, 2007, 6(20): 2464-72. |
| [8] | Renault TT, Teijido O, Antonsson B, et al. Regulation of Bax mitochondrial localization by Bcl-2 and Bcl-x(L): keep your friends close but your enemies closer[J]. Int J Biochem Cell Biol, 2013, 45(1): 64-7. |
| [9] | Lindsay J, Esposti MD, Gilmore AP. Bcl-2 proteins and mitochondria--specificity in membrane targeting for death[J]. Biochim Biophys Acta, 2011, 1813(4): 532-9. |
| [10] | Saito M, Korsmeyer SJ, Schlesinger PH. BAX-dependent transport of cytochrome creconstituted in pure liposomes[J]. Nat Cell Biol, 2000, 2(8): 553-5. |
| [11] | Yuan S, Akey CW. Apoptosome structure, assembly, and procaspase activation[J]. Structure, 2013 ,21(4): 501-15. |
| [12] | McIlwain DR, Berger T, Mak TW. Caspase functions in cell death and disease[J]. Cold Spring Harb Perspect Biol, 2013, 5(4): a008656. |
| [13] | Zhu CY, Lv YP, Yan DF, et al. Knockdown of MDR1 increases the sensitivity to adriamycin in drug resistant gastric cancer cells[J]. Asian Pac J Cancer Prev, 2013,14(11): 6757-60. |
| [14] | Wang Y, Ma G, Wang Q, et al. Involvement of CUL4A in regulation of multidrug resistance to P-gp substrate drugs in breast cancer cells[J]. Molecules, 2013,19(1):159-76. |
| [15] | Tang B, Du J, Wang J, et al. Alpinetin suppresses proliferation of human hepatoma cells by the activation of MKK7 and elevates sensitization to cis-diammined dichloridoplatium[J]. Oncol Rep, 2012, 27(4): 1090-6. |
 2014, Vol. 41
2014, Vol. 41


