文章信息
- 尹东,黄思语,邓彦超,陈艳. 2014.
- YIN Dong, HUANG Siyu, DENG Yanchao, CHEN Yan. 2014.
- N-甲基-N'-硝基-N-亚硝基胍对哈萨克族正常食管上皮细胞增殖、细胞周期及凋亡的影响
- Effects of MNNG on Proliferation, Cycle and Apoptosis of Kazakh Normal Esophageal Epithelial Cells
- 肿瘤防治研究, 2014, 41(12): 1261-1265
- Cancer Research on Prevention and Treatment, 2014, 41 (12): 1261-1265
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.12.001
-
文章历史
- 收稿日期:2013-10-08
- 修回日期:2014-02-18
2.830011乌鲁木齐,新疆医科大学公共卫生学院
3.830011乌鲁木齐,新疆食管癌研究所
4.830011乌鲁木齐,新疆医科大学第一附属医院胸外科
2.Public Health College,Xinjiang Medical University, Urumqi 830011,China
3.Xinjiang Institute for Esophageal Cancer Research,Urumqi 830011, China
4.Department of Chest Surgery, First Affiliated Hospital of Xinjiang Medical University, Urumqi 830011,China
N-亚硝胺类烷化剂作为一类化学致癌物广泛 存在于我们生活的环境中,能诱导多种疾病的发 生,因其与肿瘤发生的关系密切,故逐渐受到 研究人员的重视。N-甲基-N'-硝基-N-亚硝基胍 (MNNG) 是一种常被用于研究N-亚硝胺类化学致 癌物和致突变物的单功能烷化剂。流行病学研究表 明N-亚硝胺类化合物是诱发人类癌症原因之一[1], 动物实验证明,MNNG可诱发胃癌[2]、食管癌[3]、 结直肠癌[4]及骨肉瘤[5]等。新疆是我国食管癌高发 区之一,尤以哈萨克族(以下简称哈族)人群死亡率 最高(88.7/10万)[6]。新疆伊犁哈萨克食管癌高发 区的居民生活饮用水中含有高浓度的氨氮和硝酸盐 氮,长时间储存的熏马肠、熏马肉中存在较高含量 的生物胺,这可能为强致癌物亚硝胺类化合物的形 成创造了条件。因此,本研究使用MNNG对体外 培养的哈族食管正常上皮细胞染毒,从而模拟N- 亚硝胺类化合物暴露后,正常食管上皮细胞形态、 周期及凋亡的变化,初步探讨N-亚硝胺类化合物 致食管上皮组织发生病变的机制。
1 材料与方法 1.1 材料与试剂哈族食管正常上皮细胞株(本课题小组自行 培养的原代细胞)、MNNG(日本TCI公司)、 人正常食管上皮细胞专用培养液EpiCM-2(美国 ScienCell公司)、RPMI 1640培养液(美国Gbico 公司)、胎牛血清(美国Gibco公司)、0.05%胰 蛋白酶+0.03%EDTA、DMSO、MTT(美国Sigma 公司)、细胞周期检测试剂盒、凋亡检测试剂盒 (南京凯基生物科技有限公司)。
CO2恒温培养箱(SANYO,MAC-15AC, 日本)、倒置相差显微镜(Olympus,CK40,日 本)、酶标仪(上海新振仪器有限公司)、流式 细胞仪(美国Beckman Coulter公司)。
1.2 方法 1.2.1 细胞培养哈族食管正常上皮细胞常规培养于EpicM-2无血 清培养液中(内含青霉素100 u/ml、链霉素100 μg/ml), 37℃、5%CO2培养箱中培养,待细胞生长融合至 90%时按照1:3比例传代培养。
1.2.2 MTT法检测细胞增殖细胞生长至90%时,收集细胞并计数,调整 细胞浓度,按照1×104个/孔接种于96孔板中,每 孔200 μl。待细胞生长至对数期时,每孔加入含不同浓度(0、0.75、1.5、3 μg/ml)MNNG的培养 液200 μl,0 μg/ml为对照组,每组6个复孔。24 h 后每孔加入20 μl 5 mg/ml的MTT溶液,将96孔板 置于37℃、5%CO2培养箱中避光孵育4 h后,吸弃 液体,每孔加入150 μl DMSO,振荡10 min。使用 酶标仪于570 nm处测定每孔的吸光度(OD)值, 计算不同浓度MNNG染毒后细胞的抑制率,抑制率= (对照组OD值-实验组OD值)/对照组OD值×100%。
1.2.3 细胞周期的检测细胞生长至90%时,收集细胞并计数,接种 于25 cm2培养瓶,每瓶接种细胞5×105个。待细胞 生长至对数期时分别加入含不同浓度(0、0.75、 1.5、3 μg/ml)MNNG的培养液5 ml,作用24 h后 收集细胞,1 000 r/min离心5 min,PBS洗涤2遍, 离心后用预冷的75%乙醇固定细胞,4℃过夜。离 心收集细胞,PBS重悬,离心后弃上清液,按细胞 周期试剂盒说明书进行。室温避光30 min,流式细 胞仪检测各组细胞周期分布状况。
1.2.4 细胞凋亡检测细胞生长至90%时,收集细胞并计数,接种 于25 cm2培养瓶,每瓶接种细胞5×105个。待细胞 生长至对数期时分别加入含不同浓度(0、0.75、 1.5、3 μg/ml)MNNG的培养液5 ml作用24 h后收集 细胞,1 000 r/min离心5 min,PBS洗涤2遍。按照凋 亡试剂盒说明书进行操作,室温避光15~20 min, 于30 min内检测各组细胞凋亡情况。
1.3 统计学方法实验数据均用x±s表示,应用SPSS 17.0软件对 数据进行统计分析。多组间比较采用方差齐性检 验和单因素方差分析,两两比较采用SNK(方差 齐)或Games-Howell检验(方差不齐),以P</i>< 0.05为差异有统计学意义。
2 结果 2.1 细胞形态变化细胞经不同浓度MNNG染毒24 h后,细胞形 态发生改变。对照组细胞生长良好,细胞轮廓清 晰,边界清楚,细胞呈多角形,细胞折光性好, 胞核较大,内含1~3个核仁,见图 1A;0.75 μg/ml 组细胞生长状况和对照组相比差别不大,能够保 持细胞的正常形态,见图 1B;1.5 μg/ml组细胞 折光性降低,细胞间隙增加,胞质内出现黑色颗 粒,细胞形态发生改变,见图 1C;3 μg/ml组细胞 皱缩、变形、细胞胞质减少、部分细胞死亡,见 图 1D。

|
| A: control group(0μg/ml MNNG); B: 0.75μg/ml MNNG group; C: 1.5μg/ml MNNG group; D: 3μg/ml MNNG group 图 1 食管正常上皮细胞经不同浓度MNNG染毒24h后的形态改变 Figure 1 Cell morphological changes after infected by different concentrations of MNNG for 24h |
MNNG作用于哈族正常食管上皮细胞后,细胞 抑制率结果见表 1。与对照组比较,哈族正常食管上 皮细胞经不同浓度的MNNG染毒24 h后,各染毒组 细胞抑制率均升高,差异有统计学意义(P<0.05); 细胞抑制率与MNNG浓度呈正相关(r=0.958, P<0.05)。
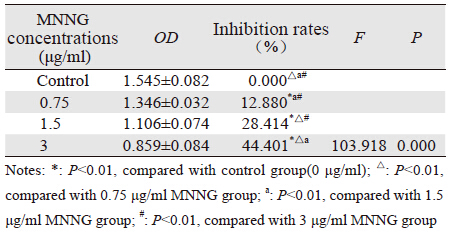 |
MNNG作用于哈族正常食管上皮细胞后,细 胞周期改变见表 2、图 2。加入MNNG 24 h后, 流式细胞仪检测结果表明,与对照组相比各浓 度组G0+G1期细胞比例均下降,差异有统计学意义(P<0.05);与对照组相比0.75 μg/ml MNNG 组S期细胞比例无明显改变,差异无统计学意义 (P>0.05),1.5 μg/ml及3 μg/ml MNNG组S期细 胞比例与对照组相比上升,差异有统计学意义 (P<0.05);与对照组相比各浓度组细胞G2+M期 比例上升,差异有统计学意义(P<0.05)。
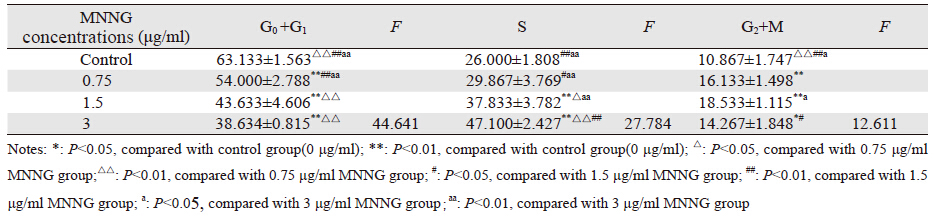 |
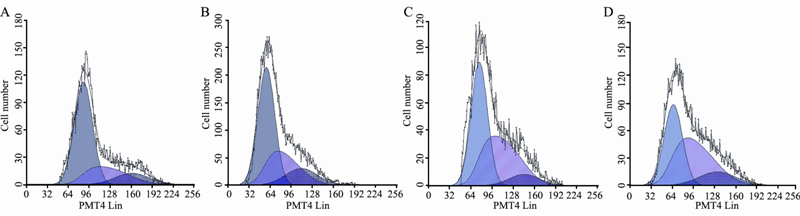
|
| A: control group(0μg/ml MNNG); B: 0.75 μg/ml MNNG group; C: 1.5 μg/ml MNNG group; D: 3 μg/ml MNNG group 图 2 流式细胞术检测不同浓度MNNG作用哈族食管正常上皮细胞24h后细胞周期变化 Figure 2 Cell cycle changes of Kazakh normal esophageal epithelial cells after infected by different concentrations of MNNG for 24h by FCM |
哈族正常食管上皮细胞在染毒24 h后,G0+G1 期细胞比例与MNNG浓度呈正相关(r=0.922, P<0.05);S期细胞比例与MNNG浓度呈正相 关(r=0.949,P<0.05);G2+M1期细胞比例与 MNNG浓度无明显相关性(r=0.308,P>0.05)。
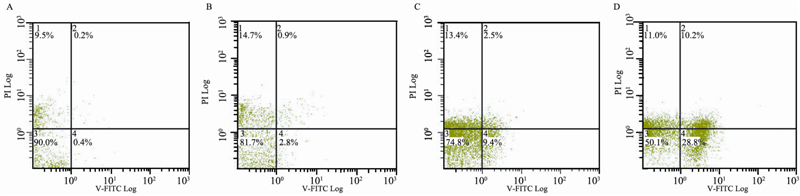
2.4 MNNG对哈族正常食管上皮细胞凋亡率的影响MNNG作用于哈族食管正常上皮细胞后, 细胞凋亡率改变,见表 3 、图 3 。加入MNNG 24 h后,流式细胞仪检测结果表明,0.75 μg/ml MNNG组细胞凋亡率与对照组相比差异无统计 学意义(P=0.335),1.5、3 μg/ml MNNG组 与对照组相比细胞凋亡率上升,差异有统计学 意义(P<0.05)。哈族正常食管上皮细胞在染 毒24 h后,凋亡细胞率与MNNG浓度呈正相关 (r=0.973,P<0.05)。
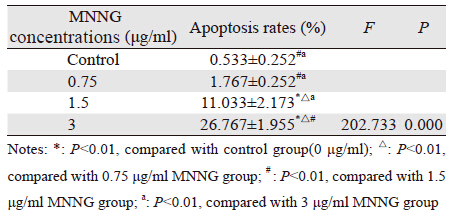 |
|
| A: control group(0μg/ml MNNG); B: 0.75 μg/ml MNNG group; C: 1.5 μg/ml MNNG group; D: 3 μg/ml MNNG group 图 3 Annexin V-FITC/PI 双染法检测不同浓度MNNG作用哈族食管正常上皮细胞24h后细胞凋亡率变化 Figure 3 Apoptosis changes of Kazakh normal esophageal epithelial cells after infected by different concentrations of MNNG for 24h by Annexin V-FITC/PI staining |
食管癌(esophageal cancer,EC)是发生于食 管上皮组织的常见消化系统恶性肿瘤,好发于发 展中国家,在世界范围内其发病率位居所有肿瘤 的第8位,每年约有46万例食管癌新发病例。世界 食管癌发病率存在明显地域差异,且显著性地域 分布是食管癌突出的流行病学特征,高低发区人 群食管癌死亡率和发病率相差可达500倍[7]。食管 癌在种族方面也有很大差异,新疆是我国食管癌 高发区之一,尤以哈萨克族人群死亡率最高[6]。
亚硝胺类化合物属亚硝基化合物,包括亚硝 胺与亚硝酞胺两类。目前为止,已发现的亚硝胺 有300多种,其中90%以上的亚硝胺化合物对动物 有致畸、致突变及致癌作用[8]。食物中的N-亚硝 基化合物的来源可分为:鱼肉制品、乳制品、蔬 菜水果、发酵食品等。除了食品来源的N-亚硝基 化合物外,人体自身也可合成一定量的N-亚硝基 化合物[9]。有研究表明亚硝胺类化合物可导致胃 癌[10]、食管癌[11]等多种肿瘤的发生。N-甲基-N'-硝 基-N-亚硝基胍(MNNG)是一种人工合成的亚硝 胺类化合物,常被用于研究亚硝胺类化合物诱发 肿瘤的工具。
原代培养的细胞直接来源于机体组织,生物 性状尚未发生大的变化,在一定程度上能够反映 体内的状态,并且细胞在传代的过程中较细胞株 具有较强的稳定性,因此我们采用原代细胞来开 展本次实验。
研究结果表明,MNNG能够抑制哈族正常食 管上皮细胞的生长,并且随着染毒剂量的增加, 细胞抑制率也逐渐上升。与文献[12]的实验结果一 致,低浓度的MNNG对细胞的生长抑制不明显, 而高浓度的MNNG可明显抑制细胞生长。通过流 式细胞仪检测细胞周期及凋亡的变化结果显示,PMNNG可导致S期细胞及G2/M期细胞比例上升, 并存在剂量依赖关系,高浓度的MNNG(>1.5 μg/ ml)可促进细胞凋亡。有关研究显示MNNG可以 引起明显的S期和G2/M期阻滞[13],并且一定浓度的 MNNG可促进细胞的凋亡[14],与本次研究结果相 同。这可能是因为MNNG作用在细胞上导致细胞 基因Cyclin E1和Cyclin E2表达上调引起细胞周期 变化[15],这需要进一步加以研究。
| [1] | B?asiak J, Trzeciak A, G?siorowska A, et al.Vitamin C and quercetin modulate DNA-damaging effect of N-methyl-N′-nitro- N-nitrosoguanidine(MNNG)[J].Plant Foods Hum Nutr, 2002, 57(1): 53-61. |
| [2] | Yamashita S, Wakazono K, Sugimura T, et al. Profiling and selection of genes differentially expressed in the pylorus of rat strains with different proliferative responses and stomach cancer susceptibility[J].Carcinogenesis, 2002, 23(6): 923- 8. |
| [3] | Takahashi H, Shikata N, Tsubura A. Immunohistochemical reaction patterns of keratins in MNNG-induced shrew oesophageal carcinomas[J].Virchows Arch, 1994, 424(3): 267-71. |
| [4] | Zhang B,Wang X,Wang Y. Altered gene expression and miRNA expression associated with cancerous IEC-6 cell transformed by MNNG[J].J Exp Clin Cancer Res, 2009, 28:56. |
| [5] | Martins-Neves SR, Lopes áO, do Carmo A, et al. Therapeutic implications of an enriched cancer stem-like cell population in a human osteosarcoma cell line[J]. BMC Cancer, 2012, 12:139. |
| [6] | Zhao FJ, Yun MY, Zhang Y, et al. The review of Xinjiang Kazak esophageal cancer[J]. Zhong Yang Ming Zu Da Xue Xue Bao(Zi Ran Ke Xue Ban), 2009, 18(3): 85-90.[赵凤娟, 云妙英, 张严, 等. 新疆哈萨克族食管癌研究进展[J]. 中央民族大学学报(自然科 学版), 2009, 18(3): 85-90.] |
| [7] | Wang LD, Zhou Q, Yang CS. Esophageal and gastric cardia epithelial cell proliferation in northern Chinese subjects living in a high incidence area[J]. J Cell Biochem Suppl, 1997, 28(29): 159-65. |
| [8] | Ma LZ, Zhang JB, Meng PP. Progress of research on the Hazards and control of N-nitrosamines in foods [J]. Bao Xian Yu Jia Gong, 2012, 12(2): 1-4,45.[马俪珍, 张健斌, 孟培培.食品中亚硝胺类化合物的危害及控制研究进展[J].保鲜与加工, 2012,12(2): 1-4,45.] |
| [9] | Zeng YC, Hu MY. Progress in research of N-nitroso compounds in food and cancer[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2008, 15(2):151-5.[曾瑶池, 胡敏予.食物中N-亚硝基化合物与肿瘤关 系的研究进展[J]. 中华肿瘤防治杂志, 2008, 15(2): 151-5.] |
| [10] | Manikandan P, Vinothini G, Vidya Priyadarsini R, et al. Eugenol inhibits cell proliferation via NF-κB suppression in a rat model of gastric carcinogenesis induced by MNNG[J]. Invest New Drugs, 2011, 29(1): 110–7. |
| [11] | Lin K, Sheng ZY, Cai SS, et al. Investigation on nitrosamines in the diets of the inhabitants of high-risk area for esophageal cancer in the Southern China and analysis of the correlation factors[J]. Wei Sheng Yan Jiu, 1997, 26(4):266-9. [林昆, 沈忠英, 蔡树深, 等.我国南方食管癌高发区膳食亚硝胺水平及其相关因素研究[J]. 卫生研究, 1997, 26(4): 266-9.] |
| [12] | Song YC, Zhao P, Fu JL, et al. The effects of N-methyl-N'-nitro- N-nitrosoguanidine on cell cycle progression in human bronchial epithelial (16HBE) cells [J].Du Li Xue Za Zhi, 2011, 25(3): 165-8.[宋彦超, 赵鹏, 傅娟玲,等.N-甲基-N'-硝基-N-亚硝基胍 对人支气管上皮16HBE细胞周期进程的影响[J].毒理学杂志, 2011, 25(3): 165-8.] |
| [13] | Yan HM, Sun ZQ, Jia B, et al. The significant of PTEN protein changes after GES-1 malignant transformed by MNNG[J]. Zhongguo Yi Liao Qian Yan, 2011, 6(23): 6,50.[闫慧明, 孙振卿, 贾彬, 等. 研究MNNG诱导GES-1发生恶性转化后PTEN蛋白的 变化意义[J]. 中国医疗前沿, 2011, 6(23): 6,50.] |
| [14] | Jaiswal AS, Multani AS, Pathak S, et al. N-methyl-N'-nitro-Nnitrosoguanidine- induced senescence-like growth arrest in colon cancer cells is associated with loss of adenomatous polyposis coli protein, microtubule organization, and telomeric DNA[J]. Mol Cancer, 2004, 3:3. |
| [15] | Li HJ, Chen WY. The study on the effect of low concentration of MNNG on expressions of CyclinE1 and CyclinE2 genes in human FL cells[J].Hangzhou Shi Fan Xue Yuan Xue Bao(Yi Xue Ban), 2008, 28(6):387-90.[李红娟, 陈维亚. CyclinE1、CyclinE2在低 浓度 MNNG诱发的FL细胞中的表达研究[J].杭州师范学院学 报(医学版), 2008, 28(6): 387-90.] |
 2014, Vol. 41
2014, Vol. 41


