文章信息
- 江昊,周涛,高亚杰,刘基巍,董岩. 2014.
- JIANG Hao, ZHOU Tao, GAO Yajie, LIU Jiwei, DONG Yan. 2014.
- 吉非替尼耐药后加量疗法对比更换厄洛替尼治疗晚期非小细胞肺癌的临床观察
- Clinical Observation of Calf Spleen Extractive Injection Combined with Docetaxel plus Capecitabine Chemotherapy in Treatment for Advanced Breast Cancer Patients
- 肿瘤防治研究, 2014, 41(11): 1223-1226
- Cancer Research on Prevention and Treatment, 2014, 41 (11): 1223-1226
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.11.014
-
文章历史
- 收稿日期:2013-09-09
- 修回日期:2013-11-13
吉非替尼(gefitinib)是首批用于晚期非小细 胞肺癌(NSCLC)的分子靶向药物,被推荐作为 具有表皮生长因子受体(EGFR)突变患者的一线治 疗药物。但在临床实践中发现,即使是EGFR突 变的患者,吉非替尼治疗的中位无进展时间仅有 6~12月,即出现吉非替尼耐药。针对这部分患者 目前尚无标准靶向药物治疗方案。吉非替尼的常 规使用剂量为250 mg,远远小于该药的最大耐受 剂量1 000 mg,因此吉非替尼耐药后通过增大剂量 可能获得肿瘤再次缓解。另外,与吉非替尼具有 相似的化学结构和作用机制的靶向药物—厄洛替 尼,更不容易受细胞色素P450途径代谢,在较低 浓度时即可对野生型EGFR存有抑制作用,因此吉 非替尼耐药后更换厄洛替尼也可能获得更好的疗效。本研究选择吉非替尼常规治疗有效(PFS>6月)的 晚期非小细胞肺癌患者,观察吉非替尼常规治疗耐 药后应用加量疗法对比更换厄洛替尼疗法的疗效。 1 资料与方法 1.1 一般资料
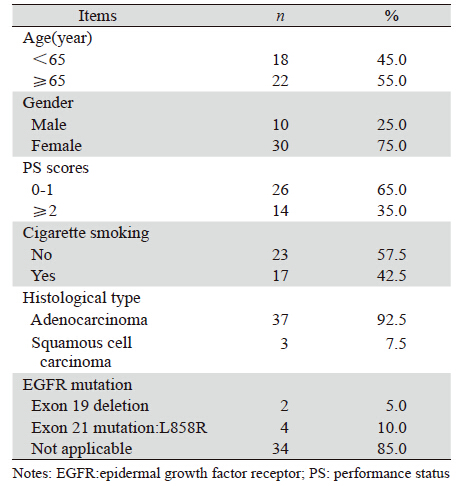
选择2007年6月—2012年5月我院收治的经细 胞学或病理学确诊的非小细胞肺癌患者,经初始 吉非替尼治疗PFS>6月后出现病情进展者40例,随 机分为吉非替尼加量组(加量组)20例、厄洛替 尼组(换药组)20例,其中包括:初始吉非替尼 治疗进展后立刻分组治疗的患者和运用一次放化 疗手段后才分组治疗的患者。两组数据均衡,所 有患者PS评分0~3分,预计生存期>3月,临床资料 记录完整,其中男性10例,女性30例,年龄36~74 岁,腺癌37例,鳞癌 3例,具体见表 1。
40例NSCLC患者既往接受过吉非替尼治疗的 有效缓解期均超过6月。加量组:初始给予吉非替 尼375 mg/d,出现病情进展后每次加量125 mg/d 直至总剂量为1000 mg/d或出现不能耐受的不良反 应或加量治疗后疾病进展时间少于2月,平均剂量 450 mg/d;换药组:给予厄洛替尼150 mg/d至病情 进展或出现不能耐受的不良反应。 1.3 疗效评价标准
疗效评价按RECIST1.1实体瘤疗效评价标 准:完全缓解(CR)、部分缓解(PR)、疾病 稳定(SD)和疾病进展(PD)。有效率(RR) =CR+PR。疾病控制率(DCR)=CR+PR+SD;无进展生存期(PFS)定义为开始接受吉非替尼加 量或更换厄洛替尼至疾病进展时间或末次随访时 间。初始疗效评价在EGFR-TKI治疗后30 d及60 d 各1次,以后每2月1次。进展后评价:以治疗加量 或换药日作为起始日,治疗后30 d及60 d评价疗 效,以后每2月1次。末次随访时间为2013年5月。 1.4 不良反应评价标准
不良反应判定参考NCI-CTC(National Cancer Institute Common Toxicity Criteria)3.0标准分为0~ Ⅳ度5个级别。 1.5 统计学方法
运用SPSS16.0软件,率的比较采用χ2检验,等 级资料采用秩和检验,生存分析采用Kaplan-Meier 法并进行Log rank时序检验,采用Log rank单因素 分析检验差异性和Cox回归多因素模型分析预后影 响因素,以P<0.05为差异有统计学意义。 2 结果 2.1 初始吉非替尼治疗疗效
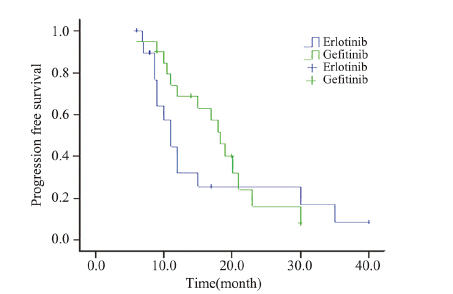
加量组初次行EGFR-TKICR治疗CR0例,PR6 例,SD9例,PD5例;换药组初次行EGFR-TKI治 疗CR0例,PR5例,SD9例,PD6例;两组中位 PFS分别为18.3月和11月,两组比较差异无统计学 意义(P=0.375),见图 1。
|
| 图 1 两组患者在初始吉非替尼治疗时期的无进展生存曲线图 Figure 1 Progression free survival curves of two groups after the initial gefitinib therapy |
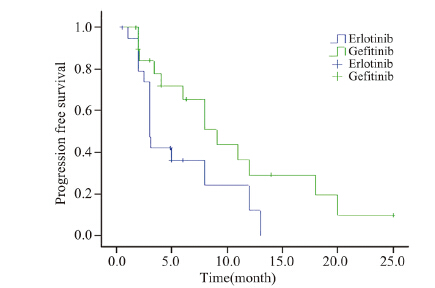
加量组:CR0例,PR2例,SD11例,PD7例; 换药组:CR0例,PR0例,SD13例,PD7例,加 量组中位PFS明显高于换药组:9.1月 vs. 3.0月 (P=0.037),见图 2。
|
| EGFR-TKI: epidermal growth factor receptor tyrosine kinase inhibitor 图 2 两组患者再次行EGFR-TKI治疗的无进展生存曲线图 Figure 2 PFS curves of two groups after 2nd EGFR-TKI therapy |
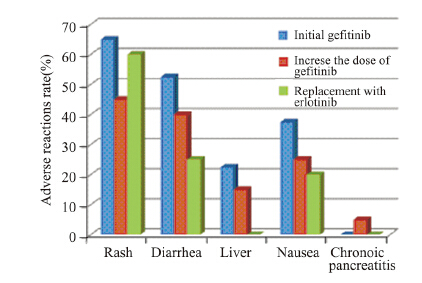
加量组与换药组的不良反应均较轻微,加量 组以腹泻、皮疹为主,其中有1例患者出现药物相 关性慢性胰腺炎,厄洛替尼组表现为Ⅰ~Ⅱ度的皮 疹,轻度的腹泻,两次TKI治疗比较差异无统计学意义(P>0.05),见图 3。
|
| 图 3 初始吉非替尼治疗与再次EGFR-TKIs治疗的不良反应 Figure 3 Adverse reactions of initial gefitinib and 2nd EGFR-TKI therapy |
单因素、多因素分析均表明,吉非替尼加 量或换用厄洛替尼治疗对预后的影响有显著性 差异(P<0.05),见表 2。多因素分析结果:再 次EGER-TKI治疗RR=0.240,P=0.009,95%CI (0.082~0.701)。吉非替尼加量或换用厄洛替尼 可作为预后的独立影响因子。
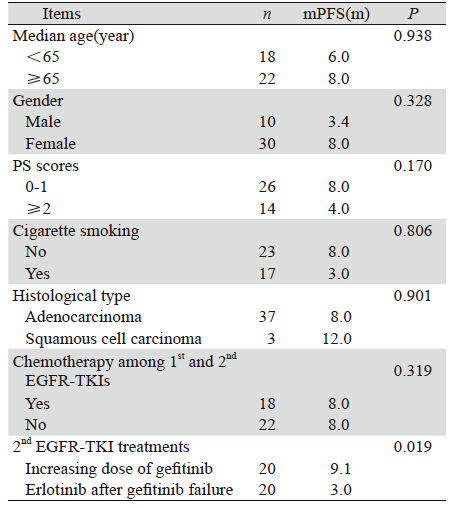 |
近年来,吉非替尼耐药机制研究成为热点, 主要包括以下四种学说:(1)EGFR基因二次 突变学说,该学说认为EGFR基因第20外显子在 吉非替尼治疗过程中发生二次突变,最常见的为 T790M突变,使得吉非替尼无法与酪氨酸激酶相 结合而耐药[1]。(2)其他酪氨酸激酶家族受体异 常活化或信号通路成分及调节因子基因表达的改 变[2,3]。(3)EGFR内化现象,即吉非替尼-EGFR 复合体进入细胞后在转运过程中发生整合异常, 导致吉非替尼无法抑制EGFR信号通路[4]。(4)肿 瘤微环境的改变,即肿瘤细胞在上皮细胞—间质转化(EMT)过程中激发多种信号通路,影响吉 非替尼发挥药理学作用[5]。因此除非发生EGFR基 因的二次突变,均可以通过增加吉非替尼剂量而 逆转耐药。即使发生T790M突变,肿瘤组织中一 些细胞可能仍对吉非替尼敏感。
韩国Oh等[6]前瞻性单中心研究表明20例吉非 替尼治疗有效的NSCLC患者再次使用吉非替尼治 疗:RR25%,DCR75%。国内李峻岭等[7]报道了18 例初始吉非替尼治疗有效的晚期肺腺癌再次使用 吉非替尼结果显示:PR1例,SD11例,PD6例, 两个研究结果均显示吉非替尼耐药可能具有时效 性,间隔治疗可能恢复吉非替尼耐药细胞的敏感 性,但这种方式可能使肿瘤在治疗间隔时期出现暴 发性生长而失去控制。吉非替尼的常规使用剂量为 250 mg,远远小于该药的最大耐受剂量1 000 mg,但 是对于吉非替尼加量的报道却十分罕见。本研究 组20例吉非替尼失败后加量给药375 mg/d,出现病情 进展后每次加量125 mg/d直至总剂量为1 000 mg/d使 血清的吉非替尼血药浓度相对高于标准剂量。本 研究加量组CR0例,PR2例,SD11例,PD7例;中 位PFS分别为9.1月。吉非替尼加量疗法可能对吉 非替尼耐药机制有所逆转,使耐药肿瘤细胞中的 信息转导通路重新开放,再次对吉非替尼敏感度 增加。相对于间隔疗法,加量疗法使患者不需承 担治疗间隔期间肿瘤失去控制的风险。
厄洛替尼虽然和吉非替尼属同一类药物,对 EGFR有相同的阻断位点和作用机制,但是并没有 证据证实两者存在交叉耐药,而有多项研究证实吉非替尼耐药后应用厄洛替尼取得较好疗效。研 究表明当吉非替尼和厄洛替尼被以标准剂量使用 时血清中厄洛替尼血药浓度高于吉非替尼[8,9]。因 此对于厄洛替尼治疗NSCLC的研究更多是针对既 往吉非替尼有效的敏感人群[10,11],显示了厄洛替尼 在吉非替尼失败后的晚期NSCLC应用的可行性。研 究发现厄洛替尼治疗有效病例多在EGFR基因野生 型或具有鳞癌、吸烟史临床特点的患者中产生[12,13]。 这是因为厄洛替尼更不容易受细胞色素P450途径 代谢,在较低浓度时即可对野生型EGFR具有抑制 作用,因此吉非替尼耐药后更换厄洛替尼也可能 获得更好的疗效。Kaira等[14]研究显示:吉非替尼 首次治疗的PFS为6.3~17.0月,换用厄洛替尼则为 1.7~5.9月。本研究显示:厄洛替尼组:CR0例, PR0例,SD13例,PD7例,RR、DCR分别为:0、 65%。中位PFS为3月,证实吉非替尼耐药后换用 厄洛替尼也是有效的治疗方式。但加量疗法在提 高患者的PFS方面更有优势。
在IDEAL-2研究中,吉非替尼的不良反应发 生率呈剂量相关性,但与治疗有效率无关。本研 究显示,使用吉非替尼加量疗法或换用厄洛替尼 疗法的不良反应发生率略有下降,程度明显减 轻,仅表现为Ⅰ~Ⅱ度的皮疹,轻度的恶心、腹 泻、肝功损害反应,虽有1例患者出现药物相关性 胰腺炎,但症状轻微,不影响治疗方案的实施。 表明两组治疗均有较好的安全性。其机制可能与 吉非替尼获得性耐药后EGFR对TKIs敏感度下降 有关。研究发现初始TKIs耐药的患者在应用化疗 后,再次使用同种TKIs药物仍有部分患者达到临 床获益,但机制并不很明确,有学者认为是因间歇 期化疗使耐药瘤细胞数目减少或重新获得对TKIs敏 感[15]。Hata等[16]报道了125例厄洛替尼治疗吉非替 尼有效的选择标准:PS评分优的,吉非替尼治疗 有效,吉非替尼与厄洛替尼治疗之间经过细胞毒 性治疗的患者。但本研究显示插入化疗未能延长 再次TKIs治疗的PFS,证实化疗不能恢复TKIs的敏 感度,以往研究中插入化疗后再次TKIs获益的患 者可能存在首次TKIs治疗剂量不足的情况。进一 步对预后因素分析显示吉非替尼常规剂量治疗失 败患者的预后与是否经过插入化疗、年龄、PS评 分、性别、组织学分型、吸烟无关,但与是否进 行吉非替尼加量治疗和换用厄洛替尼治疗相关; 多因素分析显示吉非替尼加量疗法较更换厄洛替 尼疗法可能获得更好的预后。
综上所述,初始吉非替尼治疗有效的患者出 现病情进展时,应用吉非替尼加量疗法或更换厄 洛替尼疗法均能使部分患者再次获益,且有较好 的安全性,其中加量疗法在提高患者的PFS方面更 有优势。
| [1] | Kosaka T, Yarabe Y, Endoh H, et al. Analysis of epidermal growth factor receptor gene mutation in patients with non-small cell lung cancer and acquired resistance to gefitinib[J]. Clin Cancer Res, 2006, 12(19): 5764-9. |
| [2] | Onitsuka T, Uramoto H, Nose N, et al . Acquired resistance to gefitinib: the contribution of mechanisms other than the T790M, MET, and HGF status[J]. Lung Cancer, 2010, 68(2): 198-203. |
| [3] | Pao W, Miller VA, Politi KA, et al . Acquired resistance of lung adenocarcinoma to gefitinib or erlotinib is associated with a second mutation in the EGFR kinase domain[J]. PloS Med, 2005, 2(3): e73. |
| [4] | Nguyen KS, Kobayashi S, Costa DB. Acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in nonsmall- cell lung cancer dependent on the epidermal growth factor receptor pathway[J]. Clin Lung Cancer, 2009, 10(4): 281-9. |
| [5] | Uramoto H, Iwata T, Onitsuka T, et al. Epithelial-mesenchymaltransition in EGFR-TKI acquired resistant lung adenocarcinoma[J]. Anticancer Res, 2010, 30(7): 2513-7. |
| [6] | Oh IJ, Ban HJ, Kim KS, et al. Retreatment of gefitinib in patients with non-small-cell lung cancer who previously controlled to gefitinib: a single-arm, open-label, phase Ⅱ study[J]. Lung Cancer, 2012, 77(1): 121-7. |
| [7] | Li JL, Hao XZ, Wang Y, et al. Clincal response to gefitinib retreatment of lung adenocarcinaoma patients who benefited from an initial gefitinib therapy: a retrospective analysis[J]. Zhongguo Fei Ai Za Zhi, 2012, 15(1): 44-8.[李峻岭, 郝学志, 王燕, 等. 初 始易瑞沙治疗有效的晚期肺腺癌二次使用易瑞沙的疗效分析[J]. 中国肺癌杂志, 2012, 15(1): 44-8.] |
| [8] | Baselga J, Rischin D, Ranson M, et al. Phase I safety, pharmacokinetic, and pharmacodynamic trial of ZD1839, a selective oral epidermal growth factor receptor tyrosine kinase inhibitor, in patients with five selected solid tumor types[J]. J Clin Oncol, 2002, 20(21): 4292-302. |
| [9] | Hidalgo M, Siu LL, Nemunaitis J, et al. Phase I and pharmacologic study of OSI-774, an epidermal growth factor receptor tyrosine kinase inhibitor, in patients with advanced solid malignancies[J]. J Clin Oncol, 2001, 19(13): 3267-79. |
| [10] | Wong AS, Soong R , Seah SB, et al. Evidence for disease control with erlotinib after gefitinib failure in typical gefitinib-sensitive Asian patients with non-small cell lung cancer[J]. J Thorac Oncol, 2008, 3(4): 400-4. |
| [11] | Vasile E, Tibaldi C, Chella A, et al . Erlotinib after failure of gefitinib in patients with advanced non-small cell lung cancer previously responding to gefitnib[J]. J Thorac Oncol, 2008, 3(8): 912-4. |
| [12] | Shepherd FA, Rodrigues Pereira J, Ciuleanu T, et al. Erlotinib in previously treated non-small-cell lung cancer[J]. N Engl J Med, 2005, 353(2): 123-32. |
| [13] | Cho BC, Im CK, Park MS ,et al. Phase Ⅱ study of erlotinib in advanced non-small-cell lung cancer after failure of gefitinib[J]. J Clin Oncol, 2007, 25(18): 2528-33. |
| [14] | Kaira K,Naito T, Takahashi T, et a1.Pooled analysis of the reports of erlotinib after failure of gefitinib for non-small cell lung cancer[J]. Lung Cancer, 2010, 68(1): 99-104. |
| [15] | Yano T,Haro A,Shikada Y, et al. non-small cell lung cancer in never smokers as a representative ‘non-smoking-associated lung cancer’: epidemiology and clinical features[J]. Int J Clin Oncol, 2011, 16(4): 287-93. |
| [16] | Hata A, Katakami N, Yoshioka H,et al. Erlotinib after gefitinib failure in relapsed non-small cell lung cancer: clinical benefit with optimal patient selection[J]. Lung Cancer, 2011, 74(2): 268-73. |
 2014, Vol. 41
2014, Vol. 41