文章信息
- 田聪,汤丽娜,李洪涛,林峰,沈赞,闵大六,姚阳. 2014.
- TIAN Cong, TANG Li'na, LI Hongtao, LIN Feng, SHEN Zan, MIN Daliu, YAO Yang. 2014.
- 培美曲塞联合顺铂治疗骨肉瘤肺转移的临床观察
- Clinical Curative Effects of Pemetrexed Combined with Cisplatin in Treatment for Osteosarcoma Patients with Lung Metastasis
- 肿瘤防治研究, 2014, 41(11): 1219-1222
- Cancer Research on Prevention and Treatment, 2014, 41 (11): 1219-1222
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.11.013
-
文章历史
- 收稿日期:2013-12-27
- 修回日期:2014-05-13
2. 201999 上海,上海交通大学附属第六人民医院肿瘤内科
2.Department of Oncology, The Affiliated Sixth People’s Hospital, Shanghai Jiao Tong University, Shanghai 201999,China
骨肉瘤是最常见的骨原发性恶性肿瘤,年发 病率约为2~3/100万,多发于青少年,男女之比为 1.4:1[1]。骨肉瘤需要多学科的综合治疗,强调术前 化疗-外科手术-术后化疗的规范化治疗模式。目前 常用于骨肉瘤标准一线化疗药物主要有阿霉素、 顺铂、异环磷酰胺和大剂量甲氨蝶呤。由于骨肉 瘤的综合治疗,患者5年生存率显著提高[2],然而 有的患者在初诊时就已出现肺转移,另有很大一 部分患者对标准的一线化疗药物耐药而最终治疗 失败,出现转移。一旦出现远处转移,特别是伴 有肺转移的患者,其预后往往很差[3],既往研究表 明,骨肉瘤伴肺转移患者的总生存率为0~50%[3]。 目前国际上尚无标准的骨肉瘤二线治疗方案,骨 肉瘤肺转移的二线治疗是化疗的难点,临床上迫 切需要解决晚期肺转移骨肉瘤患者的治疗问题。
大剂量的甲氨蝶呤(methotrexate,MTX)是治 疗骨肉瘤主要化疗药物之一,是一种叶酸还原酶 抑制剂[4]。而培美曲塞(商品名:力比泰)是一种 多靶点的叶酸拮抗剂,2004年2月美国FDA批准用于恶性间皮瘤的治疗[5],2004年8月被批准用于晚 期NSCLC的二线治疗[6]。基于两者具有类似药理 作用,且培美曲塞比MTX靶点更多、作用更广, 我科对一些一线化疗失败出现肺转移的骨肉瘤患 者使用培美曲塞联合顺铂方案进行治疗。现回顾 性分析2008年1月至2012年6月就诊于上海交通大 学附属第六人民医院肿瘤内科,接受培美曲塞联合 顺铂治疗的18例骨肉瘤肺转移患者,评价这些患 者的近期临床疗效及不良反应,报告如下。 1 资料与方法 1.1 研究对象
本组病例纳入标准为:(1)全部病例均经组 织活检、病理学确诊为骨肉瘤;(2)接受至少 6疗程骨肉瘤标准一线治疗方案(入组前结束化 疗超过3周),化疗方案包括:大剂量甲氨蝶呤 (8~12 g/m2)、异环磷酰胺(6~10 g/ m2)、阿霉 素(60~90 mg/ m2)及顺铂(80~100 mg/ m2); (3)影像学资料(胸部CT及病灶部位CT/MRI) 证实病情进展,出现肺转移,Enneking外科分期为 Ⅲ期,无局部复发;(4)KPS评分≥70分,预计 生存期望值≥3月;(5)无化疗禁忌证;(6)患 者及家属知情同意。本组病例排除标准为:伴有 严重内科疾患及感染;怀孕或哺乳期;同时患有 第2种恶性肿瘤;严重或不稳定的其他疾病患者。 1.2 患者一般临床资料
2008年1月至2012年6月上海交通大学附属第六 人民医院肿瘤内科共有18例晚期骨肉瘤肺转移患 者,接受培美曲塞联合顺铂方案化疗,其中男性 14例,女性4例,年龄11~57岁,中位年龄20岁; 病灶位于上肢3例,下肢13例,中轴骨2例(肋骨骨 肉瘤1例,肩胛骨骨肉瘤1例);组织病理学分型: 普通型骨肉瘤12例,小细胞型2例,髓内高分化2 例,血管扩张型1例,梭形细胞型1例;18例患者 均伴有肺转移,且为双肺多发转移,无手术切除 肺转移瘤适应证。所有病例均有可测量及评价病 灶,见表 1。
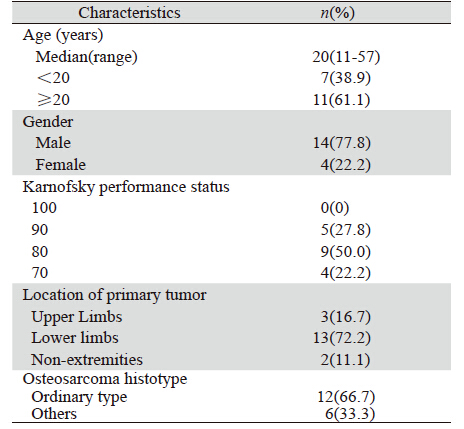 |
全组患者均接受含培美曲塞为基础的两药联 合方案治疗。具体用药:培美曲塞500 mg/m2 d1+ 顺铂80~100 mg/m2 d1~2,静脉滴注,每3周重 复。另有2例患者因胃肠反应重,于第2周期换用 培美曲塞500 mg/m2 d1 + 卡铂200 mg d1,静脉滴 注,每3周重复;给药前处理:用药前1周开始给 予口服叶酸400 μg/d,持续到治疗结束;用药前1 周给予VitB-12 1000 μg肌注,每9周1次,用药前 1天、当天和第2天口服地塞米松3.75 mg,每日2 次。用药前30 min予5-HT3受体阻断剂处理。 1.4 随访情况
截止2 0 1 3 年6 月,随访3 ~ 2 7 月,随访率 100%。疾病无进展生存时间(PFS)指从接受培美 曲塞联合顺铂方案治疗开始至疾病进展或死亡的 时间间隔,总生存时间(OS)指从接受培美曲塞 联合顺铂方案治疗开始至患者死亡的时间间隔。 1.5 疗效及不良反应评价标准
所有病例每周期化疗前后均复查肝肾功能、 血常规和心电图,每隔2个化疗周期行胸部CT及 原发病灶部位CT/MRI检查进行疗效评价,疗效 按WHO实体瘤近期疗效评定标准,分为完全缓解 (CR)、部分缓解(PR)、稳定(SD)、微小缓 解(MR)和进展(PD),以CR+PR+MR+SD计 算疾病控制率(DCR)。不良反应依据抗癌药物 毒性反应评定标准评价,分为0~Ⅳ度。 1.6 统计学方法
采用SPSS 19.0 统计软件进行处理。用Kaplan- Meier法计算疾病无进展生存时间及总生存时间, 并绘制生存曲线。 2 结果 2.1 治疗效果
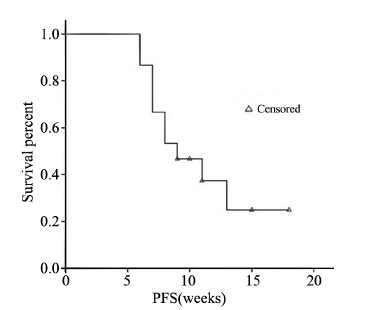
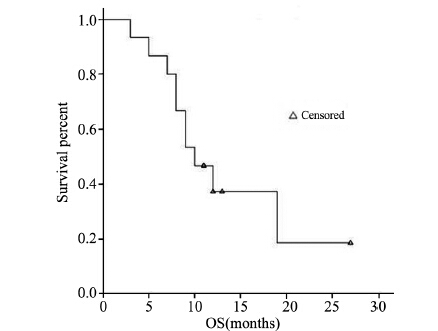
18例患者均可评价疗效,接受至少2周期治 疗,并能较好耐受,共完成53个治疗周期,平均 化疗周期数为3.0,中位化疗周期数为2.5。全组无 CR、PR病例,MR 1例,SD 7例,PD 10例,疾病控 制率(DCR)44.4% (8/18),中位无疾病进展时间为 9周(95%CI:5~13周),见图 1;中位总生存时间 为12月(95%CI:9~16月),见图 2。其中一名接受 5周期化疗的患者,其无疾病进展时间达18周。
|
| PFS: progression-free survival 图 1 培美曲塞联合顺铂方案化疗2周期后骨肉瘤肺转移患 者无疾病进展时间 Figure 1 Progression-free survival of osteosarcoma patients with lung metastasis after 2 cycles of pemetrexed combined with cisplatin |
|
| OS:overall survival 图 2 培美曲塞联合顺铂方案化疗2周期后骨肉瘤肺转移患 者总生存时间 Figure 2 Kaplan-Meier plots of overall survival of osteosarcoma patients with lung metastasis after 2 cycles of pemetrexed combined with cisplatin |
随访4~36月,中位随访时间:治疗组21.6月; 对照组11.6月。中位无进展生存时间:治疗组28.8 月,对照组6.8月。至2013年1月31日随访截止,治 疗组出现病情进展22例,死亡10例;治疗组出现 病情进展38例,死亡26例。 2.3 CBR评估
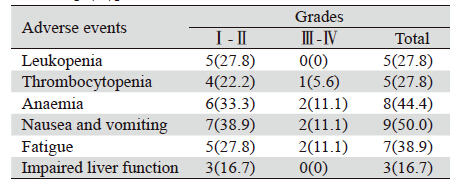
接受培美曲塞联合顺铂治疗骨肉瘤肺转移患 者未出现中止治疗的严重化疗合并症,亦无治疗 相关性死亡。由于骨髓抑制,1例患者化疗期间进 行了减量处理。最常见的不良反应为胃肠道反应 (50.0%)、贫血(44.4%)、乏力(38.9%)、 粒细胞减少(27.8%)、血小板下降(27.8%)及 肝功能损害(16.7%),最主要的Ⅲ~Ⅳ度不良反 应为胃肠道反应(11.1%)、贫血(11.1%)及乏 力(11.1%),应用重组人粒细胞集落刺激因子 (G-CSF)和低剂量的类固醇激素升白细胞,促红 细胞生成素(EPO)纠正贫血,重组人白介素-11 和重组人血小板生成素注射液升血小板及胃复 安、5-HT3受体阻断剂止吐治疗后均有明显缓解。 总体不良反应轻微,耐受性好,见表 2。
 |
骨肉瘤最常见的转移部位是肺,且肺转移是 骨肉瘤治疗失败的主要原因。然而,目前国际上 对一线化疗失败出现肺转移的患者并没有统一的 二线治疗方案,二线化疗方案也存在争议。已尝 试用于骨肉瘤肺转移二线化疗的药物有吉西他 滨、多西紫杉醇、白蛋白结合型紫杉醇、拓扑替 康、培美曲塞、雷帕霉素、三氧化二砷等。
甲氨蝶呤(MTX)是影响骨肉瘤患者预后 的主要因素之一[7],主要通过竞争性抑制细胞中 二氢叶酸还原酶,特异性抑制DNA合成,从而 发挥抗肿瘤细胞作用,并防止肿瘤耐药细胞的形 成[8, 9]。抗肿瘤新药培美曲塞是一个新的多靶点抗 叶酸化疗药物,主要通过干扰细胞复制过程中叶 酸代谢途径而发挥抗肿瘤作用。研究显示,培美 曲塞能明显抑制叶酸依赖性辅酶(胸甘酸合成酶 (TS)、二氢叶酸还原酶(DHFR)和甘氨酰胺核 苷甲酰基转移酶(GARFT))的活性,通过对这 些关键酶活性进行多靶点抑制,使得嘌呤和胸腺 嘧啶核苷生物合成减少,从而影响肿瘤细胞DNA 和RNA合成[10]。两者具有类似的药理作用,且培 美曲塞比MTX靶点更多、作用更广。培美曲塞加 顺铂的治疗方案于2004年2月被批准用于恶性间皮 瘤的一线治疗。Norris等学者进行的Ⅰ期临床试 验,显示培美曲塞对尤文肉瘤具有一定的疗效[11]。
国内外亦正逐步研究培美曲塞治疗骨肉瘤的 疗效,但结果报道不一致。Bodmer等[12]应用体 外试验比较甲氨蝶呤和培美曲塞在骨肉瘤细胞株 (SAOS-2、U2OS、143B、HOS)的疗效,结果 表明甲氨蝶呤和培美曲塞均能抑制骨肉瘤细胞株 的生长,进一步通过细胞凋亡实验得出MTX和培 美曲塞亦能诱导细胞凋亡。这项体外实验应用的 是非耐药骨肉瘤细胞系,目前并未见培美曲塞在 骨肉瘤耐药细胞株方面的体外实验研究报道。在 一项Ⅰ期研究中,Malempati等[13]观察31例使用培 美曲塞单药治疗难治性儿童实体肿瘤(其中12例骨 肉瘤)患者的临床疗效,结果12例难治性骨肉瘤患者中仅1例获SD,且应用培美曲塞不良反应较低。 Warwick等[14]学者应用培美曲塞治疗68例难治性儿 童和青少年实体肿瘤Ⅱ期临床试验中,包含10例复 发或难治性骨肉瘤患者,1例患者使用5周期培美 曲塞后,疗效评价为SD。在另一项Ⅱ期临床试验 中,Duffaud等[15]评价使用培美曲塞单药作为二线 治疗32例晚期转移性骨肉瘤患者的疗效,总有效率 (CR+PR)为3.1%,疾病控制率为18.6%,中位无 疾病进展时间为1.4月(95%CI:1.4~1.7),中位总 生存时间为5.5月(95%CI:2.3~10.5)。国内学者 林丽珠等[16]报道培美曲塞联合恩度治疗2例复发耐 药骨肉瘤患者,1例PR,1例SD,症状均减轻,生 活质量明显得到改善,KPS评分提高。
根据国内外培美曲塞相关临床试验及肿瘤化 疗药物的药理学作用,本研究对18例骨肉瘤肺转 移并经家属及患者同意后尝试性应用培美曲塞联 合顺铂方案化疗。经短期随访,本组患者的疾病 控制率(DCR)为44.4%,中位无疾病进展时间为 9.0周,中位总生存时间为12.0月。其中一名接受5 周期化疗的患者,其无疾病进展时间达18周。本 组病例数较少,系首次报道培美曲塞联合顺铂治 疗骨肉瘤肺转移的临床研究,但DCR、PFS及OS 与国外单药应用培美曲塞[13, 14, 15]相比较略好。本研 究中培美曲塞联合顺铂方案所引起的总体不良反 应小,耐受性、安全性好,可以在临床上使用。 本组选择的18例均为晚期骨肉瘤患者,伴双肺多 发转移,故总体有效率低。该研究尚有一些不足 之处,首先,骨肉瘤年发病率仅为2~3/100万,且 培美曲塞在骨肉瘤患者中的疗效仍在初步探索阶 段,并未在临床中推广使用,导致研究样本量有 限。另外,本研究属于回顾性分析,对研究对象 的选择可能存在偏倚,且随访时间较短,远期疗 效尚需进一步观察。
总之,本试验以培美曲塞联合顺铂治疗一线 化疗失败出现肺转移的骨肉瘤患者,初步结果显 示有一定的近期疗效,能较好地控制疾病进展, 且总体不良反应小、耐受性好。我们认为,培美 曲塞用于骨肉瘤肺转移的二线化疗不失为一种 积极尝试,为骨肉瘤的二线化疗提供了潜在的选 择,但尚需更多的循证医学证据,单药或联合其 他化疗药物治疗,也需开展进一步的临床研究, 探索其治疗方案和应用价值,以此为骨肉瘤肺转 移的患者提供更多的选择方案。
| [1] | Picci P. Osteosarcoma (osteogenic sarcoma)[J]. Orphanet J Rare Dis, 2007, 2:6. |
| [2] | Bielack SS, Kempf-Bielack B, Delling G, et al. Prognostic factors in high-grade osteosarcoma of the extremities or trunk: an analysis of 1,702 patients treated on neoadjuvant cooperative osteosarcoma study group protocols[J]. J Clin Oncol, 2002, 20(3): 776-90. |
| [3] | Meyer WH, Pratt CB, Poquette CA, et al. Carboplatin/ifosfamide window therapy for osteosarcoma: results of the St Jude Children's Research Hospital OS-91 trial[J].J Clin Oncol, 200l, 19(1): 171-82. |
| [4] | Lin F, Yue J, Tang LN, et al. Monitoring the plasma concentration of high-dosage of methotrexate during chemotheraphy for osteosarcoma and its clinical significance[J].Zhong Liu,2008,28(5): 440-2.[林峰,岳娟,汤丽娜,等.大剂量甲氨蝶呤 在治疗骨肉瘤中的血药浓度监测及其临床意义[J]. 肿瘤, 2008, 28(5): 440-2.] |
| [5] | Hazarika M, White RM, Johnson JR, et al. FDA drug approval summaries: pemetrexed (Alimta)[J]. Oncologist, 2004, 9(5): 482-8. |
| [6] | Cohen MH, Johnson JR, Wang YC, et al. FDA drug approval summary: pemetrexed for injection (Alimta) for the treatment of non-small cell lung cancer[J]. Oncologist, 2005, 10(6): 363-8. |
| [7] | Kudawara I, Aoki Y, Ueda T, et al. Neoadjuvant and adjuvant chemotherapy with high-dose ifosfamide, doxorubicin, cisplatin and high-dose methotrexate in non-metastatic osteosarcoma of the extremities: a phase II trial in Japan[J]. J Chemother, 2013, 25(1): 41-8. |
| [8] | Holmboe L, Andersen AM, M?rkrid L, et al. High dose methotrexate chemotherapy: pharmacokinetics, folate and toxicity in osteosarcoma patients[J]. Br J Clin Pharmacol, 2012, 73(1): 106-14. |
| [9] | Dupuis C, Mercier C, Yang C, et al. High-dose methotrexate in adults with osteosarcoma: a population pharmacokinetics study and validation of a new limited sampling strategy[J].Anticancer Drugs, 2008, 19(3): 267-73. |
| [10] | Hartmann JT, Bauer S, Egerer G, et al. Pemetrexed in patients with refractory soft tissue sarcoma: a non-comparative multicenter phase II study of the German Sarcoma Group AIO-STS 005[J]. Invest New Drugs, 2013, 31(1): 167-74. |
| [11] | Norris RE, Rappaport EF, Adamson PC. Preclinical evaluation of pemetrexed in pediatric solid tumors[J]. Pediatr Blood Cancer, 2011, 57(7):1233-5. |
| [12] | Bodmer N, Walters DK, Fuchs B. Pemetrexed, a multitargeted antifolate drug, demonstrates lower efficacy in comparison to methotrexate against osteosarcoma cell lines[J]. Pediatric Blood Cancer, 2008, 50(4): 905-8. |
| [13] | Malempati S, Nicholson HS, Reid JM, et al. Phase I Trial and pharmacokinetic study of pemetrexed in children with refractory solid tumors: the Children’s Oncology Group[J]. J Clin Oncol, 2007, 25(12):1505-11. |
| [14] | Warwick AB, Malempati S, Krailo M, et al. Phase 2 trial of pemetrexed in children and adolescents with refractory solid tumors: a Children’s Oncology Group study[J]. Pediatric Blood Cancer, 2013, 60(2): 237-41. |
| [15] | Duffaud F, Egerer G, Ferrari S, et al. A phase II trial of second-line pemetrexed in adults with advanced/metastatic osteosarcoma[J]. Eur J Cancer, 2012, 48(4): 564-70. |
| [16] | Lin LZ, Zhou JX, Zhang EX, et al. Rh-endostatin(endostar) combined with pemetrexed for two recurrent and refractory os t eos a r coma[J]. Zhongguo Zhong Liu Lin Chuang, 2007,34(20):1197-9.[林丽珠,周京旭,张恩欣,等.恩度联合 含培美曲塞方案治疗复发耐药骨肉瘤2例[J].中国肿瘤临 床,2007,34(20):1197-9.] |
 2014, Vol. 41
2014, Vol. 41


