文章信息
- 杨美玲,黎静,李志强,钟毓,王彦,李重,侯友贤,贾峻嵩,陈静. 2014.
- YANG Meiling, LI Jing, LI Zhiqiang, ZHONG Yu, WANG Yan, LI Zhong, HOU Youxian, JIA Junsong, CHEN Jing. 2014.
- 螺旋断层放疗与常规放疗在全脑全脊髓放疗中的急性血液学毒性比较
- Acute Haematological Toxicity for Patients Treated with Craniospinal Irradiation:Helical Tomotherapy Versus Conventional Radiotherapy
- 肿瘤防治研究, 2014, 41(11): 1215-1218
- Cancer Research on Prevention and Treatment, 2014, 41 (11): 1215-1218
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.11.012
-
文章历史
- 收稿日期:2013-09-18
- 修回日期:2013-11-29
2.510010 广州,广州中医药大学研究生院
2.Guangzhou University of Chinese Medicine, Guangzhou 510010, China Corresponding Author: LI Jing, E-mail:jameslijing@163.com
全脑全脊髓照射(craniospinal irradiation, CSI)主要用于治疗脑髓母细胞细胞瘤、生殖细胞 瘤和分化差的室管膜母细胞瘤等容易沿脑脊液或 脑膜播散的中枢神经系统恶性肿瘤。螺旋断层放疗(helical tomotherapy,HT)是国际上最先进的放 疗技术之一,目前国内只有少数几家单位投入临 床使用。其在CSI中存在天然的优势,一次照射可 以涵盖全脑全脊髓,避免了传统常规二维放疗技 术(conventional radiotherapy,CRT)照射野衔接产 生的剂量热点和冷点问题,但在前期的临床实践 中,我们发现其骨髓抑制程度较严重[1],现将我科 CRT与HT在CSI中急性血液学毒性对比如下,以期 为临床提供参考。 1 资料与方法 1.1 病例资料
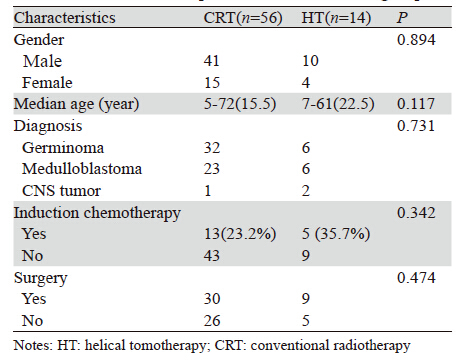
所有病例均来源于2000年1月—2013年3月在 广州军区广州总医院肿瘤科住院行全脑全脊髓放 疗的患者,年龄、性别、诊断不限。纳入标准: (1)治疗前血常规、肝肾功能正常;(2)KPS评 分≥70分;(3)放疗期间每周至少检测血常规1次 者;排除标准:(1)既往接受过放疗;(2)治疗 后复发;(3)伴有第二原发肿瘤;(4)合并其他 内科严重疾患(脑中风、高血压、糖尿病、心脏病 等)。据以上标准共70例患者纳入研究,按治疗 技术分为全脑全脊髓螺旋断层放疗组(HT)14例 和常规放疗组(CRT)56例,两组病例一般资料差 异无统计学意义(P>0.05),详见表 1。
CRT组:患者取俯卧位,身下垫10 cm厚的泡 沫板,头部垫船形枕,X光模拟机下调整体位, 热塑膜固定,并按设野要求利用低熔点铅技术制 作挡块。采用直线加速器6 MV X线,全脑照射以 左右两侧野对穿照射,脊髓照射野采用俯卧位电 子线垂直照射野,上界为全脑射野的下界(即C2或C6、C7处),下界在脊髓圆锥部(即L2、L3处), 两侧外界在椎弓根的外缘1 cm处,骶骨区域采用铲 形野照射,下界包括MRI显示的硬膜囊下界,放疗 中每周把各个野间隙的位置移动1次以避免相邻野 脊髓上出现剂量冷或热点。给予全脑全脊髓24~36 Gy,瘤灶局部推量至46~56 Gy,每次1.8~2.0 Gy,5 次/周。
HT组:患者取仰卧位,双上臂放于体侧,热塑头 膜及体膜固定体位,采用西门子Biograph 16 PET/CT 行定位扫描,层距5 mm,扫描范围从头顶到坐骨结 节,由医生逐层勾画出靶区和眼球、晶体、视神经、 肺、肾、胃、肝脏、心脏、膀胱等关键器官,并设定 关键器官的剂量限定。放疗治疗采用Tomotherapy Hi Art系统,大体肿瘤(gross target volume,GTV) 为影像学可见肿瘤,临床靶体积(clinical target volume 1,CTV1)为瘤床,CTV2为全脑和全脊髓, 计划分两段进行,全脑全脊髓30~36 Gy,瘤灶局部 推量至50~56 Gy,每次1.8 Gy,5 次/周。 1.3 治疗标准
放疗期间每周监测血常规,出现白细胞< 4.0×109/g时采取重组人粒细胞集落细胞刺激因子, 低于1.0×109/g时病房需行紫外线消毒隔离、预防性 使用抗生素等措施,当血小板<100×109/L时使用重 组人白介素-11;当血小板<25×109/L时预防性止血 治疗,紧急输注血小板。当血红蛋白<80 g/L时使用 补血药;当血红蛋白<70 g/L时,紧急输注红细胞, 期间配合口服地榆升白片、升血小板胶囊、皂矾丸 等中成药。
放疗中断定义为除外医源性耽搁和节假日休 息,连续中断放疗≥3天。当白细胞、血小板、血红 蛋白出现Ⅲ/Ⅳ度下降,经升白、升血小板、补血治 疗后1~3天复查血常规无回升,甚至继续下降者,应 中断放疗;出现重度骨髓抑制时,每天复查血象, 白细胞>4×109/g以上,血小板>50×1012/g,血红蛋白 >70 g/L,并有上升趋势者可继续放疗。 1.4 观察指标
观察患者放疗期间出现的急性血液学毒性, 毒副反应评价标准参照CTCAE v3.0 (The Common Terminology Criteria for Adverse Events v3.0)。0 度视 为正常,Ⅰ~Ⅳ度视为有不同程度血液学毒性发生, 将血液学毒性Ⅰ/Ⅱ定义为轻度抑制,Ⅲ/Ⅳ定义为重 度抑制。 1.5 统计学方法
采用SPSS19.0 统计学软件包建立数据库,组间差 异性比较采用χ2检验,P<0.05为差异有统计学意义。 2 结果
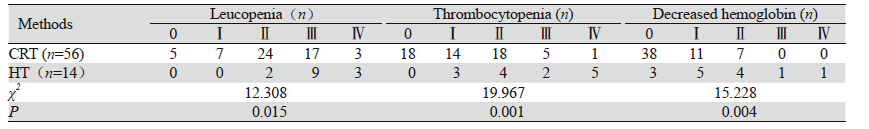
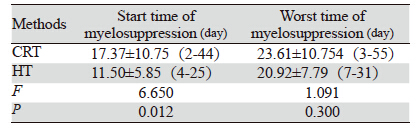
放疗期间最常见的血液学毒性为白细胞及血 小板下降,CRT组及HT组Ⅰ~Ⅳ度下降白细胞、血 小板及血红蛋白发生率分别为91.1%(51/56)、 6 7 . 9%( 3 8 / 5 6 ) 、3 2 . 1%( 1 8 / 5 6 ) 及1 0 0% (14/14)、100%(14/14)、78.6%(11/14),两 组在白细胞、血小板、血红蛋白减低方面差异均 有统计学意义(P<0.05),其中CRT组Ⅲ~Ⅳ度白 细胞下降占35.8%,Ⅲ~Ⅳ级血小板下降10.7%,无 Ⅲ~Ⅳ级血红蛋白下降;HT组Ⅲ~Ⅳ度白细胞下降 为85.7%,Ⅲ~Ⅳ级血小板下降为50%,Ⅲ~Ⅳ级血 红蛋白下降为14.2%(P<0.05),见表 2。CRT组 有6例(10.7%)患者因重度骨髓抑制中断放疗4~7 天(中位5天),经对症治疗后在1周内(4~7天, 中位5天)血象恢复正常,均按计划完成。HT组有 10例(71.4%)患者因重度骨髓抑制中断放疗3~15 天(中位9天)后完成治疗,3例(21.4%)因严重 骨髓抑制未按计划完成放疗,两组差异有统计学 意义(P<0.05)。CRT与HT组开始出现骨髓抑制 时间及骨髓抑制程度最严重时距放疗开始分别为 17.37天、23.61天及11.5天、20.92天,见表 3。
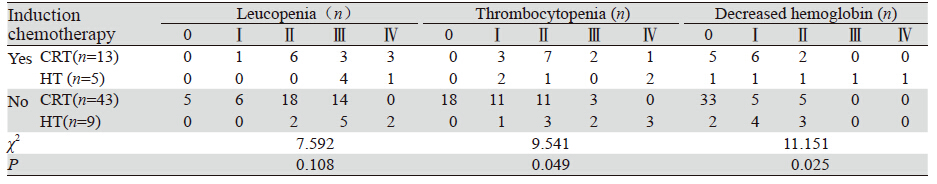
按放疗前是否化疗分组,诱导化疗组与未诱 导化疗组Ⅰ~Ⅳ度白细胞、血小板及血红蛋白下降 发生率分别为100%(18例)、100%(18例)、 66.7%(12例)及90.4%(47例)、65.4%(34 例)、32.7%(17例),两组Ⅲ~Ⅳ度白细胞、血 小板及血红蛋白下降占61.1%(11例)、27.8%(5 例)、5%(2例)及40.4%(21例)、15.4%(8 例)、0。化疗组与未化疗组在血小板及血红蛋白 方面差异有统计学意义(P<0.05),见表 4。
 |
血液学毒性是全脑全脊髓放疗的主要毒副作用 之一,严重的骨髓抑制常影响放疗的顺利进行,是 导致放疗时间延长的首要因素[2],由此可能造成肿 瘤可治愈率降低。不少学者通过改善射野设计及采 用新型放射技术减低了远期毒副反应发生风险,但 如何减轻急性期血液学毒性,一直是全脑全脊髓放 疗中的难题,不管是过去常规二维放疗技术还是目 前最先进的螺旋断层放疗技术,均存在严重血液学 毒性。
Jeffries等[3]在1998年首次综合分析了常规全脑 全脊髓放疗的血液学毒性,发现总体有33%患者 出现Ⅲ~Ⅳ级的血液学毒性,我们的研究结果显示 常规CSI重度骨髓抑制的发生率为35.8%,与文献 报道相近。螺旋断层放疗是近年出现的新技术, 其在全脑全脊髓放疗中的血液学毒性尚无大宗病 例报道,目前的单中心小样本临床报道显示,相 较常规放疗,螺旋断层放疗骨髓抑制发生程度更 甚,日本学者[4]观察了12例CSI的急性血液学毒 性,Ⅲ级以上白细胞下降的发生率达92%,血小 板下降为42%;另一些研究中CSI的重度骨髓抑制 发生率亦达58%~78%[5, 6],本研究中,HT组的Ⅲ~Ⅳ度骨髓抑制率为85.7%,显著高于CRT组,其骨 髓抑制的发生时间亦明显早于CRT组,且CRT组 仅10.7%的患者因骨髓抑制延误放疗,这一数值在 HT组却高达92.8%(包括终止治疗者),几乎所 有患者均无法完全顺利完成治疗,这提示我们, 相较CRT组,HT组患者骨髓抑制的发生率高、 程度重、发生时间早,严重影响了治疗的顺利进 行,不仅如此,因长时间的放疗中断,临床常常 需要按中断时间长短增加总剂量,但本组因HT组 骨髓抑制严重,患者完成拟定放疗计划已极为勉 强,在此前提下,临床医师往往不再考虑补量以 免增加再次严重骨髓抑制的风险,这可能影响治 疗效果。
螺旋断层放疗是将CT和直线加速器融为一 体,通过360度螺旋切割照射对肿瘤进行照射,治 疗中CT扫描能根据肿瘤和正常组织的变化及时修 改治疗计划,具有摆位误差小、治疗精度高、正 常组织保护好,远期不良反应小等优势。因此, 理论上螺旋断层放疗在CSI中存在明显的优势,但 360度旋转照射同样会使靶区周围低剂量区范围变 大,全脑全脊髓螺旋断层放疗的全身累计剂量比 常规放疗高出6.5%[7],低剂量照射面积增大是否是 加重患者骨髓抑制发生的原因尚无定论,但骨髓 为辐射敏感组织,有研究指出[8]红骨髓受照射百分 比是Ⅲ/Ⅳ度骨髓抑制最为相关的独立危险因子。 本研究组[9]曾尝试通过限制一定的照射区域以期减 少低剂量照射范围,研究中采用类似于常规放疗 技术的布野概念对胸腹部及盆腔的一定区域禁止 射线穿过,结果发现进行限制后,骨髓及全身低 剂量照射范围及剂量均较限制前下降,两者差异 有统计学意义(P<0.05)。但造血红骨髓在射野 内所占比例的下降及全身低剂量照射范围及剂量 的减低是否能减轻HT-CSI血液毒性反应,尚有待 进一步临床研究。
此外,本研究中,诱导化疗患者的骨髓抑制 发生率及重度骨髓抑制发生率均高于未化疗者, 在一项放疗相关骨髓抑制原因分析里[10],化疗后 放疗较单纯放疗骨髓抑制发生的相对危险度(OR 值)高达48.6,化疗可降低血液系统对射线的耐 受性,导致骨髓原始细胞的损伤,使得骨髓的应 激能力下降。Chang等[11]报道的CSI照射中,放疗 前化疗与单纯放疗或放疗后再化疗出现Ⅲ~Ⅳ级 骨髓抑制发生率为76% vs. 49%(P<0.05)。本研 究中,尽管在是否诱导化疗上两组构成比并无差 异(P>0.05),但HT行诱导化疗者所占比例高于CRT组(32.7% vs. 23.2%),由于本组病例数较 少,这亦可能是HT组骨髓抑制较重的原因之一, 因此,选择在CSI前尤其是HT前化疗或同期放化 疗,临床应慎重。
放疗技术的不断进步为肿瘤患者治疗带来福 音,但初步的研究结果显示全脑全脊髓螺旋断层 放疗骨髓抑制较常规放疗发生率高、时间早、程 度重,临床需引起重视,其原因及机制尚不明 确,可能与骨髓、全身低剂量照射范围及剂量、 化疗等因素相关,需要在进一步的前瞻性研究中 加以探讨,并找到改善的措施,以使螺旋断层放 疗这一先进技术造福于患者。
| [1] | Li J, Li ZQ, Wen T, et al. Observation of acute toxicity of craniospinal irradiation by helical tomotherapy[J]. Zhongguo Wei Qin Xi Shen Jing Wai Ke Za Zhi, 2013, 18(2):72-4. [黎静, 李志强, 文婷, 等. 螺旋断层放疗技术进行全中枢照射急性毒副反应的 初步观察[J]. 中国微侵袭神经外科杂志, 2013, 18(2):72-4.] |
| [2] | Paulino AC, Wen BC, Mayr NA,et al. Protracted radiotherapy treatment duration in medulloblastoma[J].Am J Clin Oncol, 2003, 26(1):55-9. |
| [3] | Jeffries S, Rajan B, Ashely S, et al. Haematological toxicity of cranio-spinal irradiation[J]. Radiother Oncol, 1998, 48(1):23-7. |
| [4] | Sugie C, Shibamoto Y, Ayakawa S, et al. Craniospinal irradiation using helical tomotherapy: evaluation of acute toxicity and dose distribution[J]. Technol Cancer Res Treat, 2011, 10(2): 187-95. |
| [5] | Mesbah L, Matute R, Usychkin S, et al. Helical tomotherapy in the treatment of pediatric malignancies: a preliminary report of feasibility and acute toxicity[J]. Radiat Oncol, 2011, 6:102. |
| [6] | Lopez Guerra JL, Marrone I, Jaen J, et al. Outcome and toxicity using helical tomotherapy for craniospinal irradiation in pediatric medulloblastoma[J]. Clin Transl Oncol, 2014, 16(1): 96-101. |
| [7] | Pe?agarícano JA, Papanikolaou N, Yan Y, et al. Feasibility of cranio-spinal axis radiation with the Hi-Art tomotherapy system[J]. Radiother Oncol, 2005, 76(1):72-8. |
| [8] | Lee IJ, Seong J, Lee CG, et al. Early clinical experience and outcome of helical tomotherapy for multiple metastatic lesions[J]. Int J Radiat Oncol Biol Phys, 2009, 73(5):1517-24. |
| [9] | Wen T, LI ZQ, Zhang JJ, et al. Craniospinal irradiation using improved helical tomotherapy: evaluation of clinical feasibility[J]. Zhongguo Yi Xue Wu Li Xue Za Zhi, 2012, 29(6):3737-41.[文婷, 李志强, 张晋建,等.改进全脑全脊髓螺旋断层放射治疗计划的 研究[J]. 中国医学物理学杂志, 2012, 29(6):3737-41.] |
| [10] | Mac Manus M, Lamborn K, Khan W, et al. Radiotherapyassociated neutropenia and thrombocytopenia: analysis of risk factors and development of a predictive model[J]. Blood, 1997, 89(7):2303-10. |
| [11] | Chang EL, Allen P, Wu C, et al. Acute toxicity and treatment interruption related to electron and photon craniospinal irradiation in pediatric patients treated at the University of Texas M. D. Anderson Cancer Center[J].Int J Radiat Oncol Biol Phys, 2002, 52(4):1008-16. |
 2014, Vol. 41
2014, Vol. 41