文章信息
- 袁明,高玲,邹清靖,汪雯雯,王世宣. 2014.
- YUAN Ming, GAO Ling, ZOU Qingjing, WANG Wenwen, WANG Shixuan. 2014.
- 缺氧诱导宫颈癌Siha细胞发生上皮-间叶转化的研究
- Epithelial to Mesenchymal Transition of Siha Cells Under Hypoxia in vitro
- 肿瘤防治研究, 2014, 41(11): 1190-1194
- Cancer Research on Prevention and Treatment, 2014, 41 (11): 1190-1194
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.11.032
-
文章历史
- 收稿日期:2014-04-13
- 修回日期:2014-08-11
2. 434020 荆州,荆州市中心医院妇 产科
2. Department of Obstetrics and Gynecology, Jingzhou Central Hospital, Jingzhou 434020, China
瘤体的过快生长造成瘤体内因血液供应不足 所致的缺氧,在肿瘤的恶性进展过程中发挥重要 作用。缺氧诱导因子1-α(hypoxia induced factor- 1α,HIF-1α)是缺氧状态下的重要核转录因子,通过调控多个靶基因参与促进肿瘤的血管增生、 转移、耐药等恶性行为[1, 2, 3]。目前研究发现,HIF- 1α在多种实体瘤包括乳腺癌、前列腺癌、肝癌 及结肠癌中表达上调,且缺氧导致的HIF-1α上 调诱发肿瘤细胞发生上皮-间叶转化(epithelialmesenchymal transition,EMT),促进肿瘤细胞迁 移、侵袭和转移,从而获得侵袭性表型[4, 5, 6]。然 而,HIF-1α能否通过EMT途径促进宫颈癌细胞的 侵袭、转移,目前尚缺乏此方面的研究。因此,本 研究采用氯化钴(CoCl2)诱导的化学缺氧处理人 宫颈鳞状细胞癌(squamous cell carcinoma,SCC) 细胞系Siha细胞,观察缺氧对人宫颈SCC Siha细胞 表型和侵袭能力的影响并探讨其可能机制。
1 材料和方法 1.1 材料兔抗人E-cadherin单克隆抗体和兔抗人HIF- 1α多克隆抗体(美国Epitomics公司),兔抗人 vimentin多克隆抗体(武汉三鹰生物技术有限公 司),鼠抗人GAPDH单克隆抗体(美国Santa公 司),SABC免疫组织化学试剂盒(武汉博士德 生物工程有限公司),HRP标记二抗和cy-3标记 二抗(武汉谷歌生物科技有限公司),DAPI染 色液(碧云天生物技术研究所),TRIzol(美 国Invitrogen公司),Matrigel胶(美国BD公司), Transwell小室(美国Milipore公司),人宫颈SCC Siha细胞系(美国ATCC实验室)。高糖型DMEM 培养液(美国Gibco公司)。胎牛血清(杭州四 季青公司)。氯化钴(CoCl2)购自美国Sigma 公司。PCR引物由武汉擎科新业生物技术有限公 司设计合成。实时定量反转录试剂盒购于日本 TaKaRa公司。
1.2 细胞的培养和缺氧处理人宫颈SCC Siha细胞用DMEM完全培养液, 在37℃、5%CO2培养箱中培养,缺氧处理是在常 氧条件的基础上将缺氧模拟剂CoCl2加入培养液 中,终浓度为200 μmol/L,用于模拟肿瘤内部的缺 氧微环境。未加CoCl2处理的为常氧对照组,CoCl2 处理组为缺氧组。
1.3 划痕实验细胞接种于6孔板内,待细胞密度达到100%时 用10 μl小枪头经孔板中心垂直划“+”字,记0 h并拍 照,于划痕后12、24、48 h拍照并计算愈合率(各 时间点划痕距离/0 h划痕距离)。
1.4 Transwell侵袭小室法检测细胞的侵袭、转移 能力用无血清DMEM调整细胞浓度为2×105 cells/ml, 在Transwell孔板上室加入200 μl细胞悬液,下室加 入600 μl DMEM完全培养液,缺氧组上室加入CoCl2 (200 μmol/L),与常氧组一起置于37℃、5%CO2培 养箱孵育48 h。棉签轻轻拭去上室内未贴壁的细胞, 4%多聚甲醛固定滤膜,结晶紫染色10 min,高倍显 微镜计数穿透到滤膜下层的细胞数,每孔随机选 择5个视野,结果求平均值。侵袭实验在Transwell 小室半透膜表面包被按1 :8比例稀释的50 mg/L matrigel(每孔100 μl)置37℃培养箱中,30 min成 凝胶,再向上室加入细胞悬液,余同前述,各项 实验重复3次。
1.5 Western blot检测相关蛋白的表达分别收集缺氧组及常氧组Siha细胞提取总蛋 白,按照试剂盒的操作步骤进行蛋白定量。60 μg 蛋白进行10%SDS-聚丙烯酰胺凝胶电泳,根据 Marker蛋白分离条带,切下电泳后目的蛋白凝胶。 电转至PVDF膜上,5%脱脂牛奶室温封闭2 h后,一 抗(稀释浓度为HIF-1α 1:200、E-cadherin 1:1 000、 vimentin 1:1 000和GAPDH 1:8 000)4℃孵育过夜。 室温洗膜,于HRP标记的二抗溶液中37℃孵育1 h。 ECL显色,采用chemi-genius凝胶成像系统分析蛋 白条带相对表达量。
1.6 免疫组织化学及免疫共聚焦分别检测HIF-1α 和E-cadherin的表达准备好常氧组及缺氧组(CoCl2处理48 h) 的爬片Siha细胞,光学显微镜下观察细胞形态学 改变并拍照,4%多聚甲醛固定,1%Triton-100 的PBS预处理后1%BSA封闭。HIF( 1 : 4 0 0 ) 、 E-cadherin(1:500)4℃孵育过夜,分别用AP及cy-3标 记的二抗工作液37℃避光孵育1 h,苏木精及DAPI 分别染核10 min,显微镜观察细胞并拍照。
1.7 实时荧光定量PCRTrizol提取总RNA,将2 μg总RNA反转录为 稳定的cDNA,扩增PCR的引物序列见表 1。扩增 条件是:95℃ 2min;95℃ 10s,57℃ 30s,72℃ 30s,40个循环。收集荧光,记录扩增曲线和溶解 曲线,记录每个样本的目的基因Ct值和内参照Ct 值(Ct值为扩增产物的荧光信号达到设定的阈值 时所经过的扩增循环次数),以GAPDH为内参 照,常氧组为对照组,采用2-ΔΔct的方法计算各目的 基因的相对表达量。
实验结果采用SPSS19.0软件分析,计量资料 以(x±s)表示,多个样本间的比较采用方差分 析,计量样本间的均数比较用t检验,P<0.05为差 异有统计学意义。
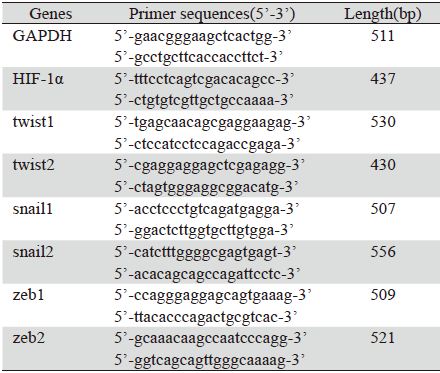
2 结果 2.1 缺氧对Siha细胞体外运动迁移能力的影响划痕实验结果显示,与常氧组比较,缺氧组 Siha细胞于12、24、48 h的愈合率明显大于常氧 对照组[12 h:(14.5±5.41) % vs.(9.3±3.56)%, 24 h:(58.9±6.32)% vs.(36.7±4.23)%,48 h: (92.7±6.53)% vs.(69.1±5.54)%],两组于24 h 和48 h时差异有统计学意义(P<0.01),见图 1。
|
| **:P<0.01,hypoxia group vs. normoxia group at different time points 图 1 划痕实验检测缺氧微环境对Siha细胞运动迁移能力的 影响 Figure 1 Effect of hypoxia microenvironment on migration of Siha cells detected by wound-healing assay |
常氧组Siha细胞每高倍视野透膜细胞数为 (213±13),缺氧组每高倍镜视野下的细胞数为 (430±7);小室半透膜表面铺matrigel胶后,常 氧组siha细胞透膜细胞数为(167±15),缺氧组细 胞透膜细胞数为(311±21),两组比较差异具有 统计学意义(P<0.01)。
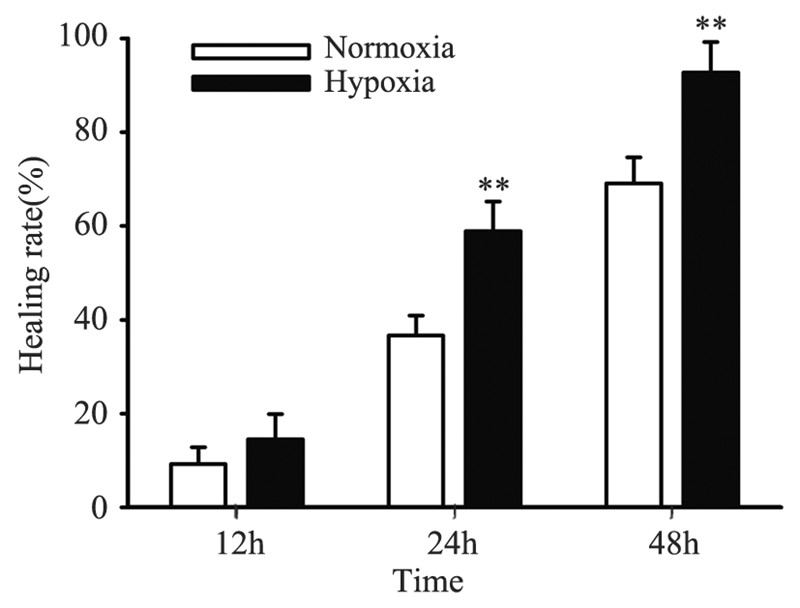
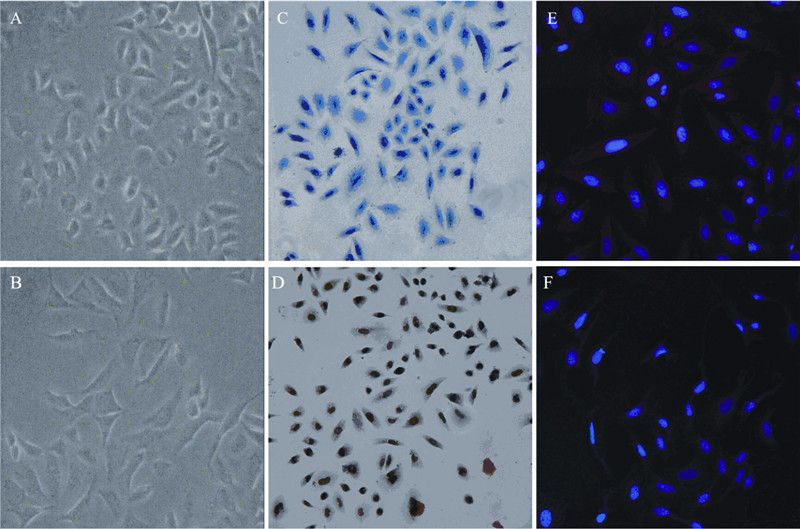
2.3 Siha细胞系缺氧微环境诱导对EMT的影响观察细胞形态发现Siha细胞经缺氧处理后长 梭形更加明显即间质化形态更加明显,见图 2B; 光学显微镜可见HIF-1α在Siha细胞中聚集,见图 2C,证实CoCl2成功模拟细胞缺氧状态;细胞免 疫荧光共聚焦结果显示,与常氧组相比EMT的 相关上皮性标志蛋白E-cadherin在缺氧组Siha中 呈现微弱红色荧光,见图 2F。蛋白质印迹法结 果显示,随着缺氧时间的延长,HIF-1α的表达出 现先增加,随后降低的趋势,且于缺氧后24 h表 达量最高;而上皮性标志蛋白E-cadherin的表达 随缺氧时间延长表达逐渐下调,间质性标志蛋白 vimentin表达逐渐上调,见图 3,差异有统计学意 义(P<0.05)。
|
| A,C,E:normoxia control group; B,D,F:hypoxia group; C,D: HIF-1α expression (yellow);E,F: E-cadherin expression stained by DAPI(blue) and marked by cy-3(red) 图 2 缺氧对Siha细胞的形态学和上皮性标记E-cadherin表达的影响 Figure 2 Effect of hypoxia microenvironment on morphology and E-cadherin expression of Siha cells |
|
| 图 3 Western blot检测缺氧对人宫颈SCC Siha细胞HIF- 1α、上皮性标记E-cadherin及间质性标记vimentin转录后蛋 白表达水平的影响 Figure 3 Effect of hypoxia microenvironment on expression of HIF-1α and EMT markers,E-cadherin and vimentin, detected by Western blot |
经缺氧模拟剂CoCl2处理后,HIF-1α mRNA的 相对表达量逐渐升高,随着化学缺氧导致的HIF- 1α的激活,缺氧环境下Siha细胞snail1/2 mRNA的 表达量逐渐升高,与HIF-1α呈正相关;且观察到 twist2的表达亦随着缺氧时间的延长表达上调,但 twist1 mRNA的表达与缺氧6 h后表达无差异,与缺 氧12 h后表达上调明显;但zeb1/2mRNA的相对表 达在常氧组、缺氧6 h组、缺氧12 h组比较差异无 明显统计学意义(P>0.05),见图 4。
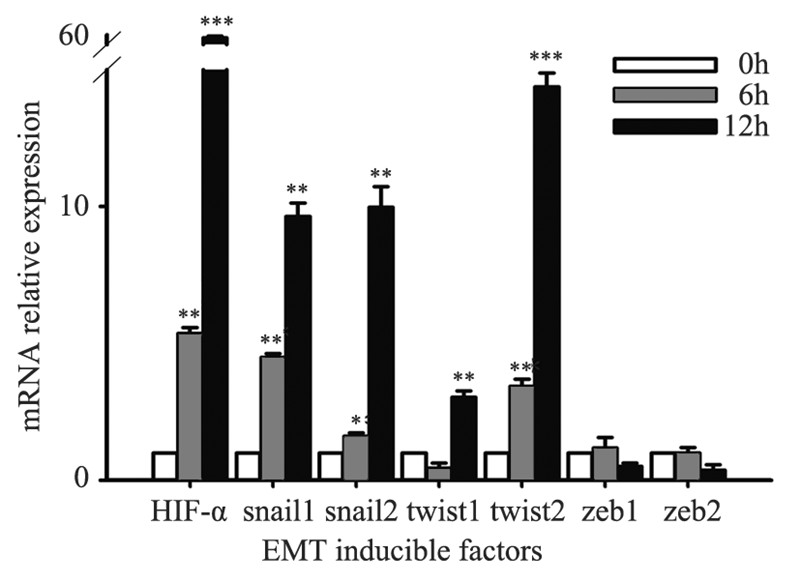
|
| *:P<0.05,**:P<0.01,***:P<0.001,compared with 0h group,changes of EMT markers expression under hypoxia microenvironment for 12 and 24h 图 4 实时定量PCR检测缺氧12、24h后EMT诱导因子 Snail、Twist、Zeb mRNA的表达变化 Figure 4 mRNA expression of EMT inducible factors, snail,twist and zeb,under hypoxia environment for 12 and 24h detected by qRT-PCR |
恶性肿瘤在快速增殖过程中可致局部组织缺 氧,促使处于缺氧状态的肿瘤细胞发生一系列 适应性反应,如血管形成、能量供应等;另一 方面,缺氧状态下效应因子HIF-1α上调,进而与 其下游靶基因的缺氧反应元件(hypoxia response element,HRE)结合,启动下游基因的转录,包括血管内皮生长因子(VEGF)、葡萄糖转运体1 (GLUT1)、多耐药基因1(MDR1)、促红细胞 生成素、E-cadherin等基因,共同参与肿瘤的恶性 进展[7]。2006年Erler团队的研究证实缺氧微环境可 上调赖氨酰化酶来促进人乳腺癌及头颈部肿瘤的 远处转移[8];同年,Krishnamachary等[9]提出HIF- 1α可诱导肿瘤发生EMT从而促进其转移,且这一 作用是通过HIF-1α直接抑制E-cad的表达来实现 的。近来,在多种肿瘤的研究中发现,缺氧是肿 瘤细胞发生EMT,获得迁徙、侵袭、转移能力的 主要诱导因素之一。
CoCl2作为一种常用的低氧模拟剂,其作用 机制是通过抑制脯氨酰羟化酶活性,从而起到稳 定HIF-1α的作用。根据本实验室前期研究成果及 参考文献[10],选定200 μmol/L的CoCl2模拟细胞低 氧,可不影响细胞活力并避免细胞毒性的产生。 本研究结果显示,CoCl2诱导的化学缺氧状态下, 人宫颈SCC Siha细胞迁徙、侵袭、转移能力增强, 不仅如此,处于缺氧微环境中的Siha细胞丧失了 上皮细胞特有的形态,而呈现出类似成纤维细胞 样的长梭形,排列也变得更为紊乱。此外,E-cad 的表达随着缺氧时间的延长逐渐降低,而间质性 标记Vimentin的表达随缺氧时间的延长逐渐增加, 提示缺氧可抑制Siha细胞的上皮表型,诱导Siha细 胞发生EMT,促进其侵袭性表型。在已知的EMT 诱导转录因子twsit、snail、slug、zeb中,本研究 结果显示,宫颈癌细胞缺氧状态下EMT诱导因子 twsit和snail上调,与缺氧时间呈正相关,推测HIF- 1α可能参与调控转录因子twsit和snail的表达,而在 前期研究中[11, 12],twsit和snail已被证实可诱导宫颈 癌细胞发生EMT导致肿瘤不良预后,提示缺氧诱 导宫颈癌Siha细胞发生EMT并增强其侵袭性表型的作用可能是缺氧微环境对EMT诱导因子的直接 调控作用导致的。
在其他肿瘤的研究中,HIF-1α直接调控EMT 诱导因子的现象已被证实。Yang等在研究人头颈 部肿瘤的恶性进展过程中发现,HIF-1α可直接结 合转录因子twist启动子区的缺氧反应原件调控其 表达,进而促使肿瘤的转移及恶性进展[13];此外, Zhang等[14]在肝癌的研究中发现,HIF-1α通过靶向 snail启动子区的两个缺氧反应元件上调snail的表 达,诱导肝癌细胞发生上皮间质性转化,获得侵 袭性表型,这些结果很好地解释了HIF-1α诱导EMT 发生的机制。另一方面,亦有报道称HIF-1α可通 过TGF-β通路直接诱导EMT[15],而在本研究中,缺 氧微环境激活HIF-1α,上调EMT诱导因子twist和 snail表达,提示缺氧诱导人宫颈癌细胞发生EMT 并获得侵袭性表型可能是通过上调twist/snail发挥 作用的。
综上所述,缺氧微环境条件下HIF-1α激活诱 导EMT参与宫颈癌恶性进展,可能与其对EMT 诱导因子的直接调控相关,基于这一结果,针对 HIF-1α的深入研究将为宫颈癌的诊治提供新的思 路。
| [1] | Gort EH, Groot AJ, van der Wall E,et al. Hypoxic regulation of metastasis via hypoxia-inducible factors[J]. Cur Mol Med,2008,8(1):60-7. |
| [2] | Vaupel P, Thews O, Hoeckel M. Treatment resistance of solid tumors: role of hypoxia and anemia[J]. Med Oncol, 2001,18(4):243-59. |
| [3] | Harrison L, Blackwell K. Hypoxia and anemia: factors in decreased sensitivity to radiation therapy and chemotherapy? [J]. Oncologist, 2004,9 Suppl 5:31-40. |
| [4] | Schwab LP, Peacock DL, Majumdar D, et al. Hypoxia-inducible factor 1α promotes primary tumor growth and tumor-initiating cell activity in breast cancer[J]. Breast Cancer Res,2012,14(1): R6. |
| [5] | Copple BL. Hypoxia stimulates hepatocyte epithelial to mesenchymal transition by hypoxia-inducible factor and transforming growth factor-beta-dependent mechanisms[J]. Liver Int, 2010, 30(5): 669-82. |
| [6] | Krishnamachary B, Berg-Dixon S, Kelly B, et al. Regulation of colon carcinoma cell invasion by hypoxia-inducible factor 1[J]. Cancer Res, 2003, 63(5): 1138-43. |
| [7] | Semenza G. Signal transduction to hypoxia-inducible factor 1[J]. Biochem Pharmacol, 2002, 64(5-6): 993-8. |
| [8] | Erler JT, Bennewith KL, Nicolau M, et al. Lysyl oxidase is essential for hypoxia-induced metastasis[J]. Nature, 2006, 440(7088): 1222-6. |
| [9] | Krishnamachary B, Zagzag D, Nagasawa H, et al. Hypoxiainducible factor-1-dependent repression of E-cadherin in von Hippel-Lindau tumor suppressor-null renal cell carcinoma mediated by TCF3, ZFHX1A, and ZFHX1B[J]. Cancer Res, 2006, 66(5): 2725-31. |
| [10] | Cheng YX, Pu DM, Liu R, et al. Influence of hypoxia inducible factor-1α on cervical cancer cell line HeLa in vitro[J].Zhonghua Fu Chan Ke Za Zhi, 2007, 42(8): 551-4.[程艳香, 濮德敏, 刘嵘, 等. 低氧诱导因子1α对子宫颈癌细胞生物学行为的影响[J]. 中华妇产科杂志, 2007, 42(8): 551-4.] |
| [11] | Li Y, Wang W, Wang WW, et al. Correlation of TWIST2 upregulation and epithelial-mesenchymal transition during tumorigenesis and progression of cervical cancer[J]. Gynecol Oncol, 2012,124(1): 112-8. |
| [12] | Lee MY, Chou CY, Tang MJ, et al. Epithelial-mesenchymal transition inf cervical cancer: correlation with tumor progression, epidermal growth factor receptor overexpression and snail upregulation[ J]. Clin Cancer Res, 2008, 14(15): 4743-50. |
| [13] | Yang MH, Wu MZ, Chiou SH, et al. Direct regulation of TWIST by HIF-1alpha promotes metastasis[J]. Nat Cell Biol, 2008, 10(3): 295-305. |
| [14] | Zhang L, Huang G, Li X, et al. Hypoxia induces epithelialmesenchymal transition via activation of SNAI1 by hypoxiainducible factor -1α in hepatocellular carcinoma[J]. BMC Cancer, 2013, 13: 108. |
| [15] | Matsuoka J, Yashiro M, Doi Y, et al. Hypoxia stimulates the EMT of gastric cancer cells through autocrine TGFβ signaling[J]. PloS one, 2013, 8(5): e62310. |
 2014, Vol. 41
2014, Vol. 41