文章信息
- 肖丹,刘安文. 2014.
- XIAO Dan, LIU Anwen. 2014.
- 慢病毒介导的RNAi沉默TLR4基因对人乙肝病毒相关肝细胞癌裸鼠移植瘤生长的影响
- Effect of Silencing TLR4 Gene by RNA Interference Carried by Lentiviral Vector on Subcutaneous Tumor of Human Hepatitis B Virus-associated Hepatocellular Carcinoma in Nude Mice
- 肿瘤防治研究, 2014, 41(11): 1171-1175
- Cancer Research on Prevention and Treatment, 2014, 41 (11): 1171-1175
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.11.013
-
文章历史
- 收稿日期:2013-08-26
- 修回日期:2014-02-24
肝细胞癌(hepatocellular carcinoma,HCC) 为原发性肝癌的主要类型,根据世界卫生组织提 供的最新资料显示,全球每年约有60万人死于 HCC[1]。在我国,乙肝病毒(hepatitis B virus, HBV)感染是肝细胞癌的主要病因之一,流行病学资料表明,慢性HBsAg携带者患肝癌的危险度 比非感染人群高25~37倍[2, 3]。Toll 样受体4(Toll like receptor 4,TLR4)是先天性免疫系统中能够 识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs)的一种受体,分布于体内 各种细胞表面[4]。研究表明TLR4在多种肿瘤中高 表达,尤其是炎症相关性肿瘤,TLR4可能通过促 进肿瘤细胞增殖、抑制肿瘤细胞凋亡及免疫逃逸等 机制参与炎性反应相关性肿瘤的发生、发展[5, 6, 7, 8]。 为了解TLR4基因不同表达对人乙肝病毒相关肝细 胞癌裸鼠移植瘤生长的影响,我们应用RNA干扰 (RNA interfering,RNAi)技术构建TLR4基因RNA 干扰的重组慢病毒载体,建立人乙肝病毒相关肝 细胞癌裸鼠移植瘤模型,观察重组慢病毒载体对 乙肝病毒相关性肝细胞癌裸鼠移植瘤TLR4基因表 达和肿瘤生长的影响。
1 材料和方法 1.1 材料15只雄性4~5周鼠龄裸小鼠(BALB/C-nu) 购自湖南斯莱克景达实验动物有限公司[动物许 可证号:SCXK(湘)2011-0003],人HBV阳性 HepG3B肝癌细胞株购自中国科学院细胞库(上 海),Lipofectamine 2000购自Invitrogen公司,反 转录试剂盒购自Takara试剂公司,TLR4多克隆抗 体购自Santa公司。
1.2 方法 1.2.1 细胞培养人HBV阳性HepG3B肝癌细胞株 用含10%FBS的MEM培养液培养,加青霉素(100 u/ml)和链霉素(100 μg/ml),在37°C、5%CO2 恒温箱内培养。
1.2.2 质粒构建由上海Invitrogen公司设计并构 建四种质粒及一种阴性对照质粒,TLR4干扰序列 见表 1。质粒抽提按照TIANGEN质粒大提试剂盒 说明书进行。
收集HepG3B 细胞,以1×105个/孔细胞铺六孔板,待细胞生长密 度至90%时按照Lipofectamine2000试剂说明书转 染(质粒DNA与脂质体比为1:3),48 h后收集细 胞,用Western blot检测TLR4蛋白表达,选择干扰 效果最好的质粒用于裸鼠实验。
1.2.4 慢病毒载体的构建将干扰效果最好的质 粒及阴性对照质粒送至上海Invitrogen公司进行慢 病毒包装。
1.2.5 人乙肝病毒相关肝细胞癌裸鼠移植瘤动物 模型的建立与实验分组培养的HepG3B细胞经胰 酶消化后离心,用PBS洗2次,将细胞团块吹散, 调整细胞浓度为每0.2毫升5×106个。取5×106个 (0.2 ml)细胞接种于每只裸鼠右后腿背部皮肤, 继续饲养。待肿瘤最长径约为0.8 cm时,随机分为 3组,即实验组、阴性对照组和空白对照组,每组 5只,分别向三组动物瘤内注射TLR4 miRNA慢病 毒颗粒(滴度为3.5×107 TU/ml)、携带无关序列 的慢病毒颗粒(滴度为1×108 TU/ml)和0.9%氯化钠 溶液,隔天1次,共5次。实验组和阴性对照组每 次瘤内注射慢病毒每只2×107 TU,用无血清MEM培养液稀释至0.2 ml;空白对照组则每次瘤内注射 0.2 ml 0.9%氯化钠溶液,注射部位为肿瘤四周加中 央共五点。
1.2.6 裸鼠移植瘤生长情况每两天测量瘤体的 长径(a)与短径(b),并计算瘤体体积(TV): TV=1/2 ×(a×b2),绘制肿瘤生长曲线。首次瘤内注 射后第11天颈椎脱臼法处死裸鼠,剥取瘤体组织。
1.2.7 半定量RT-PCR检测裸鼠移植瘤中TLR4 mRNA的表达Trizol法提取移植瘤组织的总 RNA,反转录成cDNA。TLR4引物序列为:正 义:5’-GGTCAGACGGTGATAGCGAG-3’,反 义:5’-ATTAGGAACCACCTCCACGC-3’,反应条 件为:94℃预变性5 min,然后94℃变性30 s,62℃ 退火 30 s,72℃ 延伸45 s,共33个循环,72℃延伸 8 min,扩增产物为179 bp;内参GAPDH引物序 列为:正义:5’-GTTGGAGGTCGGAGTCAACGGA- 3’,反义:5’-GAGGGATCTCGCTCCTGGAGGA- 3’,反应条件为:94℃预变性5 min,然后 94℃变性30s,64℃退火30 s,72℃延伸45 s,共33个 循环,72℃延伸8 min,扩增产物为240 bp。PCR 产物在1.5%琼脂糖凝胶电泳后观察并拍照,实验 重复3次,并用凝胶图像处理系统分析目标带。
1.2.8 Western blot检测裸鼠移植瘤中TLR4蛋白 的表达常规方法提取组织总蛋白,BCA法进行 蛋白浓度测定。取60 μg总蛋白上样,SDS-PAGE 电泳分离,转膜,5%脱脂奶粉室温封闭2 h,一 抗(1:500)4°C孵育过夜,二抗(1:5 000)室 温孵育2 h,进行化学发光反应,暗室中显影、定 影。实验重复3次,将胶片进行扫描或拍照,用凝 胶图像处理系统分析目标带。
1.3 统计学方法采用SPSS13.0统计软件对数据进行统计分 析,以P<0.05为差异有统计学意义。 2 结果 2.1 Lipofectamin 2000转染效率检测
细胞转染后24 h,在荧光显微镜下观察绿色 荧光蛋白的表达情况,见图 1。随机取10个低倍视 野,计算转染细胞占细胞总数的百分比来评价转 染效率。结果显示6 μl脂质体包被2 μg质粒转染效 率达(48 ± 2.76)% 。
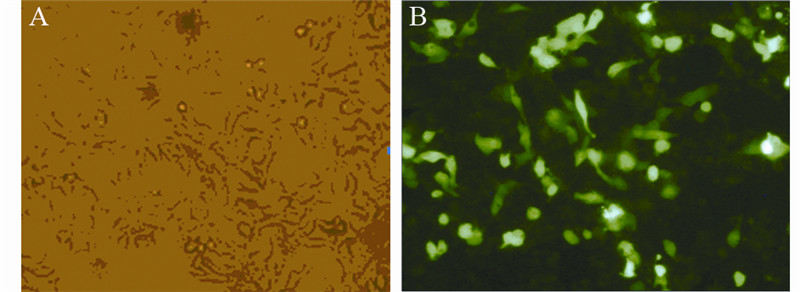
|
| A: cellular morphology and distribution before transfection; B:the expression of green fluorescent protein after transfection 图 1 荧光显微镜下脂质体法转染miR-TLR4质粒24 h后绿 色荧光蛋白的表达 (×200) Figure 1 The expression of green fluorescent protein under the fluorescence microscope after transfected for 24 h (×200) |
转染干扰片段1、2、3、4及阴性对照片段与对照组 相比,转染干扰片段3和4后,TLR4蛋白表达量显著减 少,且干扰片段3干扰效果最明显(P<0.05),见图 2。
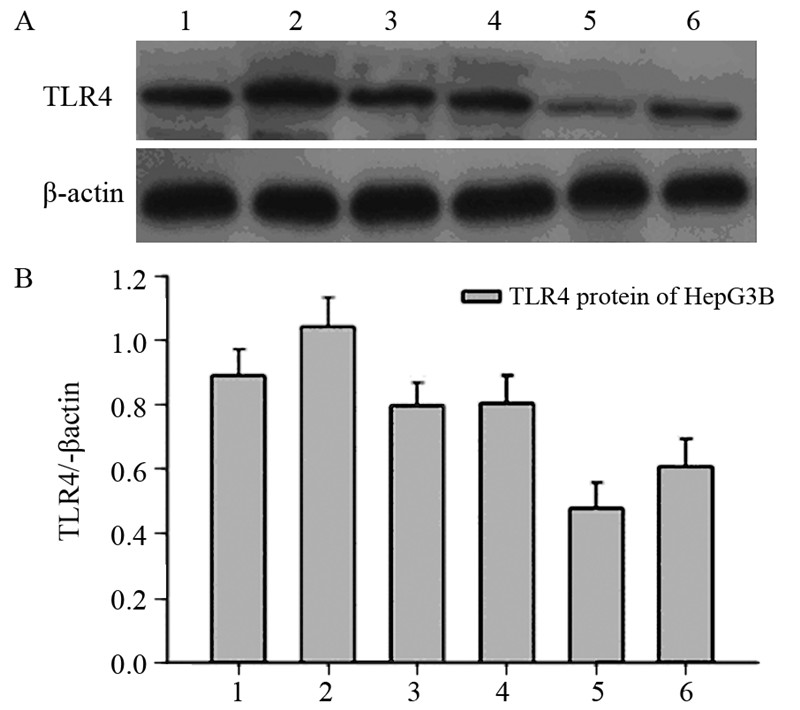
|
| A:TLR4 protein expression in different transfection groups;B:histogram of TLR4 protein expression; 1:non transfection group;2:negative fragment;3:interference fragment 1;4:interference fragment 2;5: interference fragment 3;6:interference fragment 4 图 2 不同转染组TLR4蛋白的表达 Figure 2 TLR4 protein expression in different transfection groups |
慢病毒包装3号质粒用于实验组,根据每次 测量瘤体长径和短径计算出来的瘤体体积TV并 绘制出3组皮下移植瘤生长曲线,见图 3。空白对 照组和阴性对照组剥脱的瘤体体积分别为(2 263 ±180.67)mm3和(2 142±190.56) mm3,而实验 组剥脱的瘤体体积为(908±78.43) mm3,见图 3。结果表明,与空白对照组和阴性对照组相比, 实验组肿瘤生长速度明显减慢(P<0.05);空白 对照组和阴性对照组相比,差异无统计学意义 (P>0.05)。
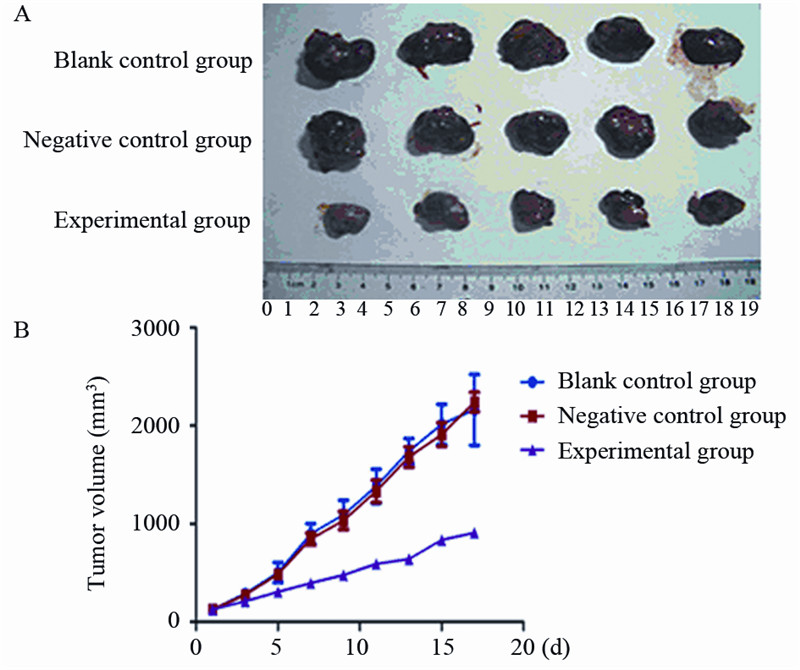
|
| A:the size of subcutaneous tumors in different groups;B:growth curves of subcutaneous tumors in nude mice in different groups 图 3 各组移植瘤瘤体及生长曲线 Figure 3 The size and growth curves of subcutaneous tumors in different groups |
实验组移植瘤组织在179 bp处的特异性条带 与空白对照组和阴性对照组相比更暗;半定量 RT-PCR结果分析表明,实验组TLR4 mRNA的表达量低于空白对照组和阴性对照组(P<0.05), 空白对照组与阴性对照组差异无统计学意义 (P>0.05),见图 4。
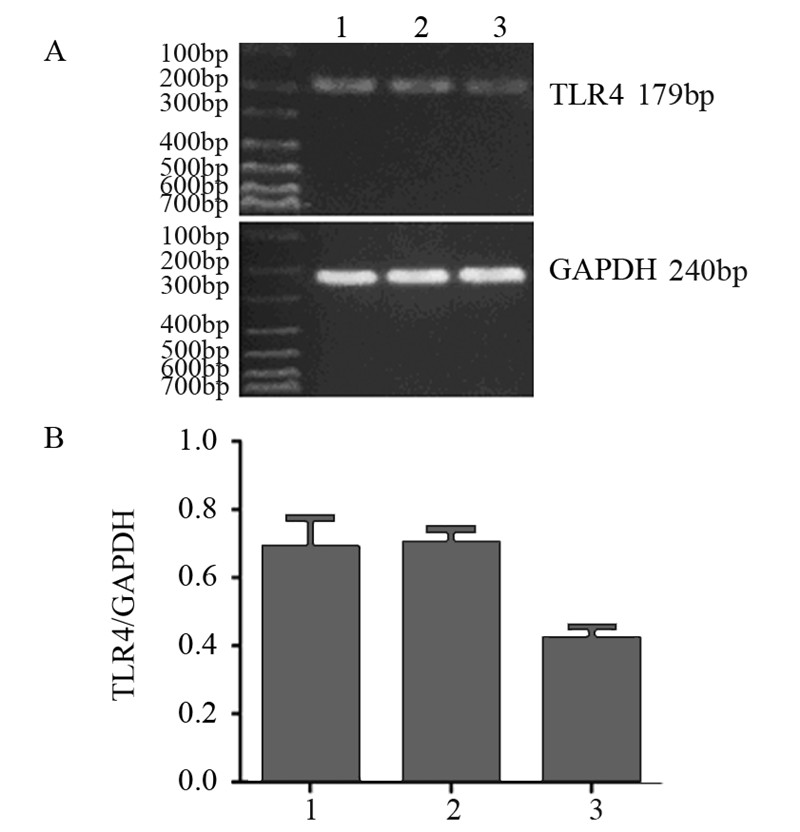
|
| A:the expression of TLR4 mRNA in subcutaneous tumors in different groups;B:histogram of TLR4 mRNA expression in subcutaneous tumors in different groups; 1:blank control group;2:negative control group;3:experimental group 图 4 RT-PCR分析各组裸鼠移植瘤组织TLR4 mRNA的表达 Figure 4 RT-PCR analysis of TLR4 mRNA expression in subcutaneous tumor tissues in nude mice in different groups |
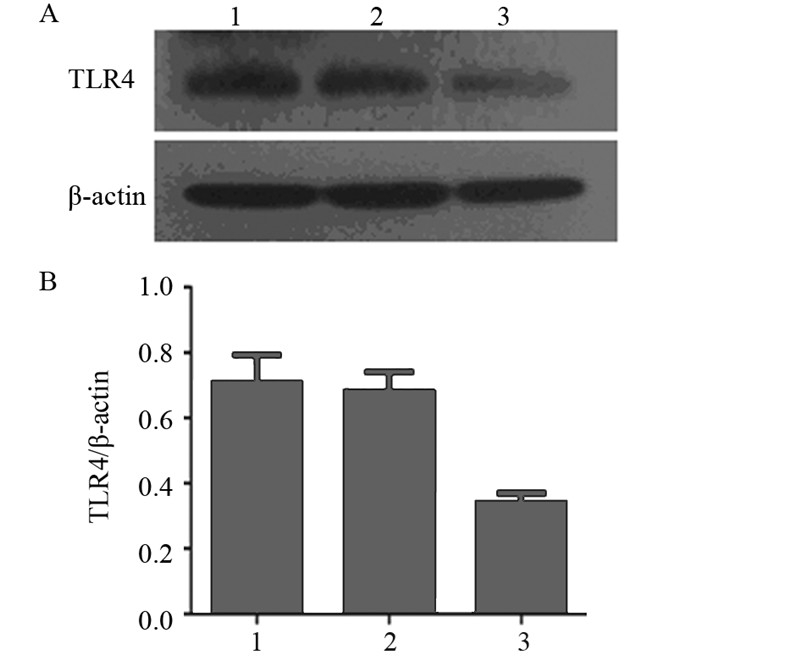
Western blot结果显示,实验组移植瘤组织中 TLR4蛋白表达量明显低于空白对照组和阴性对照 组(P<0.05),空白对照组与阴性对照组差异无 统计学意义(P>0.05),见图 5。
|
| A:the expression of TLR4 protein in subcutaneous tumors in different groups;B:histogram of TLR4 protein expression in subcutaneous tumors in different groups; 1:blank control group;2:negative control group;3:experimental group 图 5 Western blot分析各组裸鼠移植瘤组织TLR4蛋白表达 Figure 5 Western blot analysis of TLR4 protein expression in subcutaneous tumor tissues in nude mice in different groups |
Toll样受体4(Toll-like receptor 4,TLR4)属 于Ⅰ型跨膜蛋白,系Toll样受体(Toll-like receptors, TLRs)中的一员,由细胞外区、跨膜区和细胞内 区三个部分组成。细胞外区由亮氨酸重复序列组 成,细胞内区由Toll同源结构域和羧基端长短不同 的短尾肽组成,同源结构域与白细胞介素-1受体 (IL-1R)胞质区结构相似,成为Toll样受体/白细 胞介素-1同源结构域(TIR)。TIR区域是TLR4与 其下游相关的信号转导分子,如髓样分化蛋白88 (MyD88)、IL-1相关蛋白激酶(IRAK)、肿瘤 坏死因子受体活化因子6(TRAF-6)和蛋白激酶 (AP)等相互作用的关键部位[9, 10]。TLR4主要分 布于外周血单个核细胞和淋巴样组织,还分布于 其他组织细胞如肠道及胆道上皮细胞、库普弗细 胞、脂肪细胞、肝星状细胞等[4, 11]。
近年来大量研究表明,TLR4与肿瘤密切相 关,尤其是炎症相关性肿瘤。有研究证实TLR4上 调与慢性炎症和肝纤维化形成有关,TLR4信号 能有效的激活NF-κB,从而促进肿瘤的发生发展 [12];Jing等[13]检测了106例肝癌组织标本中TLR4的 表达,其中101例(86%)标本显示TLR4阳性, 且进一步研究证实LPS诱发的TLR4信号涉及肝癌 的侵袭和转移,其机制可能是通过TLR4直接激活 NF-κB信号而实现的。同时也有研究认为(Helico-bater pylori,HP)是通过LPS-TLR4通路促进胃癌的 生长;Yokota等[14]认为HP的LPS是通过LPS-TLR2- MEK1/2-ERK1/2MAPK-NF-Y通路上调TLR4表达 和促进胃癌细胞增殖。另外也有研究表明,TLR4 在炎症性肠病和结直肠癌的发生、发展中有重要 作用,且TLR4/MyD88信号通路与结直肠癌的预后 不良有关;在炎症性肠病向恶性肿瘤转化过程中 有多种分子机制参与,其中2个关键基因是COX-2 和NF-κB[15, 16]。此外,Cheng等[17]研究证实TLR4在 宫颈癌中高表达,由HPV LPS激活的TLR4信号有 促进细胞增殖和抗凋亡的作用,而且TLR4信号还 能通过激活NF-κB信号通路来促进免疫抑制因子 IL-6和TGF-B1的分泌,从而促进宫颈癌的发展。 可见TLR4的过度表达在肝癌、胃癌、结直肠癌和 宫颈癌等炎症相关性肿瘤发生过程中可能起促进 作用。
本实验设计并在体外化学合成4 对TLR4 - miRNA序列,利用脂质体转染法转入乙肝病毒阳 性肝癌Hep3B细胞中,通过Western blot技术检测转 染后TLR4基因蛋白水平的表达,从而筛选出干扰 效果最明显的序列用于裸鼠成瘤实验。在本研究 中,成功建立了人乙肝病毒相关肝细胞癌裸鼠移 植瘤模型,于瘤内注射重组慢病毒载体,利用RTPCR 和Western blot技术检测移植瘤组织中TLR4基 因mRNA和蛋白水平的表达,结果显示实验组移 植瘤组织内TLR4基因的mRNA和蛋白表达量都明 显下降。同时,通过绘制肿瘤生长曲线显示,沉 默TLR4基因后,明显抑制了裸鼠移植瘤的生长, 但其具体机制尚不清楚,有待进一步研究论证。
综合以上结果,本研究表明TLR4基因沉默表 达可抑制人乙肝病毒相关肝细胞癌裸鼠移植瘤的 生长,有可能为乙肝相关肝细胞癌的靶向治疗提 供一个新的思路。
| [1] | Boyle p, Levin B. World cancer report 2008[M]. Switzerland: WHO Press,2009:350. |
| [2] | Aravalli RN, Steer CJ, Cressman EN. Molecular mechanisms of hepatocellular carcinoma[J]. Hepatology, 2008, 48(6):2047-63. |
| [3] | Tsai WL, Chung RT. Viral hepatocarcinogenesis[J]. Oncogene, 2010, 29(16):2309-24. |
| [4] | Siednienko J, Miggin SM. Expression analysis of the Toll-like receptors in human peripheral blood mononuclear cells[J]. Methods Mol Biol,2009:517:3-14. |
| [5] | Machida K, Tsukamoto H, Mkrtchyan H, et al. Toll-like receptor 4 mediates synergism between alcohol and HCV in hepatic oncogenesis involving stem cell marker Nanog[J]. PNAS, 2009, 106(5): 1548-53. |
| [6] | Tang XY, Zhu YQ, Wei B, et al. Expression and functional research of TLR4 in human colon carcinoma[J]. Am J Med Sci, 2010, 339(4): 319-26. |
| [7] | Chochi K, Ichikura T, Kinoshita M, et al. Helicobacter pylori augments growth of gastric cancers via the lipopolysaccharidetoll- like receptor 4 pathway whereas its lipopolysaccharide attenuates antitumor activities of human mononuclear[J]. Clin Cancer Res, 2008, 14(10): 2909-17. |
| [8] | Cheng YX, Qi XY, Huang JL, et al. Toll-like receptor 4 signaling promotes the immunosuppressive cytokine production of human cervical cancer[J]. Eur J Gynaecol Oncol, 2012, 33(3): 291-4. |
| [9] | Soares JB, Pimentel-Nunes P, Roncon-Albuquerque R, et al. The role of lipopolysaccharide/Toll-like receptor 4 signaling in chronic liver diseases[J]. Hepatol Int, 2010, 4(4): 659-72. |
| [10] | Krishnan J, Selvarajoo K, Tsuchiya M, et al. Toll-like receptor signal transduction [J]. Exp Mol Med, 2007, 39(4): 421-38. |
| [11] | Soares JB, Pimentel-Nunes P, Roncon-Albuquerque R, et al. The role of lipopolysaccharide/toll-like receptor 4 signaling in chronic liver diseases[J]. Hepatol Int, 2010, 4(4): 659-72. |
| [12] | Wei XQ, Guo YW, Liu JJ, et al. The significance of Toll-like receptor 4(TLR4) expression in patients with chronic hepatitis B[J]. Clin Invest Med, 2008, 31(3): E123-30. |
| [13] | Jing YY, Han ZP, Sun K, et al. Toll-like receptor 4 signaling promotes epithelial-mesenchymal transition in human hepatocellular carcinoma induced by lipopolysaccharide[J]. BMC Med, 2012, 10: 98. |
| [14] | Yokota S, Okabayashi T, Rehli M, et al. Helicobacter pylori lipopolysaccharides upregulate toll-like receptor 4 expression and proliferation of gastric epithelial cells via the MEK1/2-ERK1/2 mitogen-activated protein kinase pathway[J]. Infect Immun, 2010, 78(1): 468-76. |
| [15] | Kraus S, Arber N. Inflammation and colorectal cancer[J]. Curr Opin Pharmacol, 2009, 9(4): 405-10. |
| [16] | Wang EL, Qian ZR, Nakasono M, et al. High expression of Tolllike receptor 4/myeloid differentiation factor 88 signals correlates with poor prognosis in colorectal cancer[J]. Br J Cancer, 2010, 102(5): 908-15. |
| [17] | Cheng YX, Qi XY, Huang JL, et al. Toll-like receptor 4 signaling promotes the immunosuppressive cytokine production of human cervical cancer[J]. Eur J Gynaecol Oncol, 2012, 33(3): 291-4. |
 2014, Vol. 41
2014, Vol. 41



