文章信息
- 林碧华,马晓娟,万树伟,蔚帅帅,张鑫,周克元. 2014.
- LIN Bihua, MA Xiaojuan, WAN Shuwei, YU Shuaishuai, ZHANG Xin, ZHOU Keyuan. 2014.
- 佛手柑内酯对鼻咽癌细胞凋亡的影响
- Bergapten Induces Apoptosis of Nasopharyngeal Carcinoma Cells
- 肿瘤防治研究, 2014, 41(11): 1163-1170
- Cancer Research on Prevention and Treatment, 2014, 41 (11): 1163-1170
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.11.005
-
文章历史
- 收稿日期:2014-01-25
- 修回日期:2014-03-20
鼻咽癌(nasopharyngeal carcinoma,NPC)为 我国华南地区常见的恶性肿瘤之一,在临床治疗 中通常以放疗为主并辅以适当的化疗[1]。因缺乏对 复发及转移的有效控制,传统的放化疗手段在提 高鼻咽癌患者生存率方面遇到了瓶颈,寻找新的 治疗手段及辅助药物显得刻不容缓。中药是一个 巨大的药物分子宝库,从中药中开发低毒高效的抗 恶性肿瘤药物一直是国内外的研究热点。佛手柑内 酯(Bergapten)为呋喃香豆素类天然产物,广泛 存在于植物界中,更是中药蛇床子[2]、白芷[3]、北 沙参[4]及化橘红[5]等主要有效成分之一。佛手柑内 酯运用于白癜风等皮肤病的临床治疗在国外已经 有几十年历史,而最近的研究发现其对乳腺癌细 胞具有抑制增殖并诱导凋亡的作用,但佛手柑内 酯对鼻咽癌细胞的作用鲜有报道,其诱导凋亡的具体机制更不明确。为了验证佛手柑内酯能诱导 鼻咽癌细胞发生凋亡,及进一步探讨其可能的机 制,进行了如下研究。
1 材料与方法 1.1 细胞与主要试剂鼻咽癌细胞CNE-2及HONE-1均为广东医学 院生物化学与分子生物学教研室(研究所)长 期传代培养及规范冻存。RPMI1640培养液、 0.25%胰蛋白酶液、胎牛血清(FBS)及TRIzol 裂解液购自Invitrogen公司(美国)。二甲基乙砜 (DMSO)、佛手柑内酯及普通化学试剂均购于 阿拉丁(上海)。CCK-8细胞增殖毒性检测试剂 盒购自同仁化学研究所(日本),FastQuant反转 录试剂盒及RealMasterMix (SYBR Green)定量PCR 试剂盒购自宝生物公司(大连),BAX、BCL2、 STAT3及p-STAT3 (Y705)兔单抗购自CST公司(美 国),PVDF膜、ECL发光液购自Millipore公司 (美国),Annexin V-FITC/PI凋亡检测试剂盒与 JC-1线粒体电位检测试剂盒、Caspase-3活性检测 试剂盒、辣根过氧化物酶标记的山羊抗兔二抗、 RIPA裂解液、5×蛋白上样缓冲液购自碧云天生 物研究所(上海)。7500实时定量PCR为Applied Biosystems公司产品(美国),多功能酶标仪为 BioTek公司产品,垂直电泳系统、槽式转膜系 统及冷凝CCD成像系统为Bio-Rad公司产品(美 国),FACSCanto Ⅱ流式细胞分析仪为BD公司产 品(美国)。
1.2 细胞培养CNE-2及HONE-1的完全培养液为含10% FBS、100 u/ml 青霉素、100 mg/L链霉素的 RPMI1640培养液。待细胞生长至单层密度为80% 时进行传代,用0.25%胰蛋白酶液消化3 min左右, 弃去消化液加入适量完全培养液吹打细胞培养 面,制得细胞悬液,并以5×104/cm2重新接种,24 h 左右换液一次。
1.3 实验分组及处理本实验每种细胞分4组:对照组为加入DMSO 处理48 h,浓度为每毫升培养液加入1 μl DMSO; 加药组为加入佛手柑内酯的DMSO溶液处理48 h, 其中加药组分三个浓度(1、10、100 μM),选定 依据见CCK-8法检测毒性。
1.4 CCK-8法检测毒性将细胞接种于96孔培养板,加入终浓度分别在 0.1~1 mM的含佛手柑内酯培养液正常培养48 h,当 培养时间结束时,弃去原培养液,每孔加入含10% CCK-8的培养液,5% CO2、37°C孵育2 h,酶标仪 检测各孔吸光度,扣除背景值后以对照组为基准 计算各药物浓度的抑制率,利用两点法计算半数 抑制浓度。
1.5 Annexin V-FITC/PI法检测细胞凋亡按1.3实验分组处理细胞,胰酶消化细胞后收 集,根据试剂盒说明书操作:离心弃上清并用PBS 洗涤细胞1次,同前弃尽上清液后,按每1×105细 胞加入195 μl Annexin V-FITC结合液重悬细胞后, 加入5 μl Annexin V-FITC混匀,室温避光孵育10 min。离心弃上清液后,加入190 μl Annexin V-FITC 结合液重悬细胞,加入10 μl PI染液混匀后冰浴。 随即进行流式细胞分析仪检测,调整并收集每个 样品的前散射光(FSC)、侧散射光(SSC)、绿 光(Annexin V-FITC)和红光(PI)四个通道的 信号,并以FSC/SSC作散点图圈出主细胞群,再 以Annexin V-FITC/PI对主细胞群作图分出Annexin V-FITC阳性、PI阴性或阳性的凋亡细胞群(Q2与 Q3细胞群的和),得到每组细胞的凋亡率。
1.6 Caspase-3活性检测按1.3实验分组处理细胞,胰酶消化细胞后收 集,600 g离心5 min,弃上清液并用PBS洗涤细胞 1次,同前弃尽上清液后,按每2×106细胞加入100 μl裂解液比例加入裂解液,冰浴裂解15 min,按 天冬氨酸特异性半胱氨酸蛋白酶-3(Caspase-3) 活性检测试剂盒说明书操作,检测各组样品 Caspase-3的活性。同时利用Bradford蛋白定量试 剂盒对各组样品裂解液进行蛋白定量分析,选用 对照组为参照,计算各组样品的Caspase-3相对活 性。
1.7 JC-1法检测细胞线粒体膜电位按1.3实验分组处理细胞,根据试剂盒说明书 操作:弃去原培养液,用PBS洗涤细胞2次,加入 配制好的1 ml JC-1染色工作液,37°C避光孵育20 min,弃上清液,用0.25%胰酶消化细胞,PBS洗 涤并重悬细胞。随即进行流式细胞分析仪检测, 调整并收集每个样品的前散射光(FSC)、侧散 射光(SSC)、绿光(JC-1 Green)和红光(JC-1 Red)四个通道的信号,并以FSC/SSC作散点图圈 出主细胞群,再以JC-1 Green/Red对主细胞群作图 分出JC-1 Green阳性、JC-1 Red阳性的高线粒体电 位细胞(Q2细胞群),JC-1 Green阳性、JC-1 Red 阴性的低线粒体电位细胞(Q3细胞群),利用Q3 与Q2的比值表示线粒体膜电位的高低。
1.8 实时定量RT-PCR检测法按实验分组处理后,弃去原培养液,加入 TRIzol室温裂解5 min,每1 ml TRIzol裂解液加入0.2 ml氯仿,剧烈振摇30 s,静置5 min。4ºC 12 000 g离 心15 min,吸取上清液至新离心管中,加入等体积 的异丙醇,吹打均匀,静置10 min,4ºC 12 000 g离 心5 min,用含75%乙醇的DEPC水溶液洗涤RNA沉 淀,稍事干燥后,用DEPC水溶解RNA。测得浓度 后按FastQuant RT Kit (With gDNase)说明书操作, 进行反转录;按RealMasterMix (SYBR Green)说明 书操作(引物序列见表 1),在7500实时定量PCR 系统上,选用ddCt相对定量法进行检测分析,其中 选用对照组为参照,内参基因为β-actin,计算各目 标基因的相对mRNA表达量。
按实验分组处理后,弃去原培养液,PBS洗 2次,加入RIPA裂解液冰上裂解30 min,收集裂 解液,4ºC 12 000 g 离心15 min,收集上清液,按 BCA蛋白定量试剂盒说明书进行蛋白定量,向上 清液加入体积量1/4的5×上样缓冲液,沸水浴10 min后,冰浴5 min。使用SDS-PAGE蛋白电泳系 统,上样量为50 μg总蛋白,电泳参数为10%分离 胶、5%浓缩胶,100 V电泳90 min至溴酚蓝指示剂 迁移至底部后,进行电转移,使用0.2 μm的PVDF 膜,300 mA冰浴电转90 min。电转结束后,膜使 用5%脱脂奶粉封闭30 min,TBST漂洗3次每次5 min,加入稀释的一抗工作液(按产品说明书稀释 配制),4ºC孵育过夜,TBST漂洗3次每次5 min, 加入稀释的二抗工作液(按产品说明书稀释配 制),室温孵育1 h,TBST漂洗3次每次5 min,加 入ECL发光液,置ChemiDoc XRS+成像系统中, 检测化学发光情况。条带采用Quantity One软件的 光密度分析,按以下公式计算目标基因的相对蛋白 表达量:相对蛋白表达量=(目标条带光密度实验组 /内参条带光密度实验组)/(目标条带光密度对照组/内 参条带光密度对照组)
STAT3蛋白Y705位点的磷酸化水平的计算公 式:磷酸化水平=(磷酸化蛋白条带光密度实验组/总 蛋白相对表达量实验组)/(磷酸化蛋白条带光密度对照组/总蛋白相对表达量对照组)
1.10 白介素-6刺激经佛手柑内酯处理的鼻咽癌细胞100 μM佛手柑内酯及20 μM STA-21分别作用 42 h后,在培养液中加入终浓度为10 ng/ml的人重 组白介素-6(interleukin-6,IL-6)共处理6 h,按1.8 测定BCL2基因及BAX基因的mRNA水平。
1.11 统计学方法每次实验设3复孔,每组实验重复3次以上, 所得数据用SPSS19.0软件进行统计学分析;计量 资料用均值±标准差(x±s)表示,多组间比较采 用单因素方差分析,组间两两比较采用LSD-t检验 或Dunnett T3检验,检验水平α = 0.05。
2 结果 2.1 CCK-8法检测毒性结果利用CCK-8法计算佛手柑内酯对体外培养的 人鼻咽癌细胞CNE-2作用48 h的半数抑制浓度为 (143.7±9.7) μM,HONE-1作用48 h的半数抑制 浓度为(73.4±7.2) μM。本实验选用的三个剂量 组48 h抑制率分别为:CNE-2细胞1 μM抑制率为 (4.6± 1.2)%,10 μM抑制率为(9.9±1.9)%, 100 μM抑制率为(37.9±3.1)%;HONE-1细胞1 μM抑制率为(9.5±2.2)%,10 μM抑制率为(20.1 ± 2.9)%,100 μM抑制率为(63.6±1.6)%。三 组浓度对两种鼻咽癌细胞的抑制率跨度明显且合 理,可满足后续实验要求。
2.2 Annexin V-FITC/PI法检测细胞凋亡结果佛手柑内酯作用48 h后,利用Annexin V-FITC/ PI法标记每组细胞后流式细胞分析仪检测。从典 型流式分布图和多次实验所得凋亡率柱状图可 知,加药处理的10 μM浓度组与100 μM浓度组的凋 亡率相对于对照组明显升高(P<0.05),见图 1。
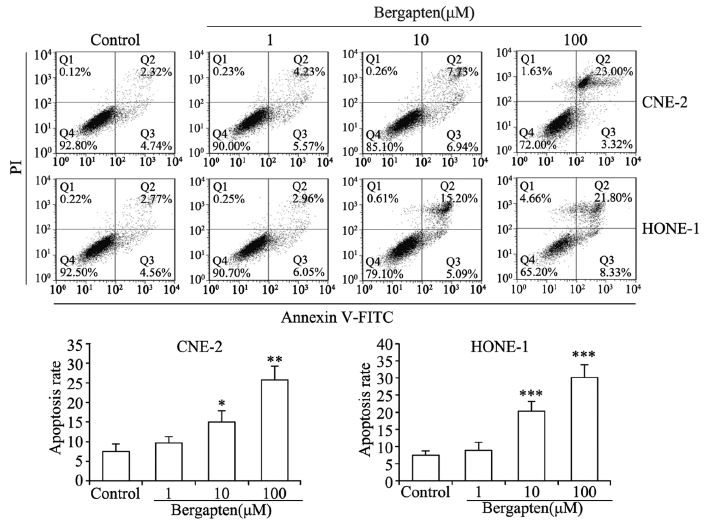
|
| *: P=0.021,**: P=0.002,***: P<0.001,compared with control group 图 1 Annexin V-FITC/PI法检测佛手柑内酯作用后CNE-2 和HONE-1细胞凋亡 Figure 1 Apoptosis of CNE-2 and HONE-1 cells treated with bergapten detected by Annexin V-FITC/PI |
佛手柑内酯作用48 h后,检测各组Caspase-3的 活性。加药处理的三个浓度组(1、10、100 μM) 的Caspase-3活性较对照组明显升高(P<0.05), 且呈浓度依赖性,见表 2。
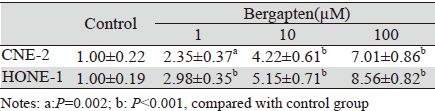 |
佛手柑内酯作用48 h后,检测各组细胞线粒体 膜电位。从典型的细胞线粒体膜电位流式分布图 和多次实验所得Q3与Q2的比值柱状图可知,加药处理的三个浓度组(1、10、100 μM)的线粒体膜 电位相对于对照组明显降低(P<0.05),见图 2。
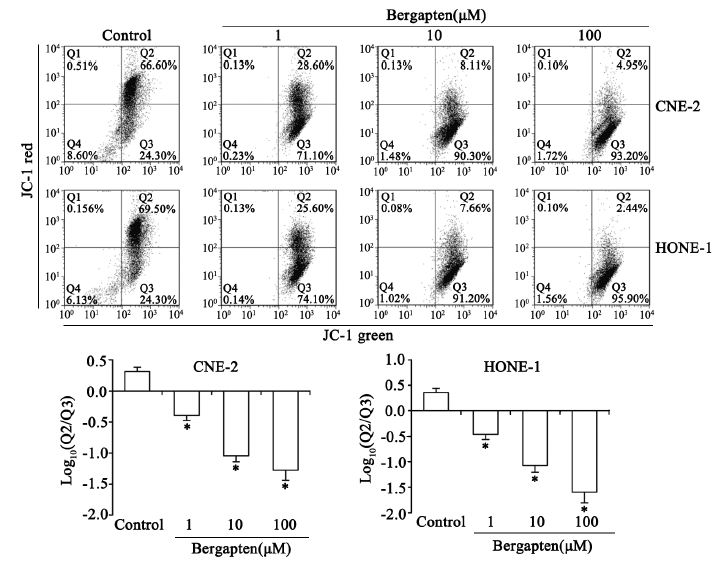
|
| *: P<0.001,compared with control group 图 2 JC-1测定佛手柑内酯作用后CNE-2和HONE-1细胞线粒体膜电位 Figure 2 Mitochondrial membrane potential of CNE-2 and HONE-1 cells treated with bergapten detected by JC-1 |
佛手柑内酯作用48 h后,利用实时定量RTPCR 检测各组细胞中BAX和BCL2基因的mRNA水 平。随着浓度的升高,BAX基因的mRNA表达量上 升,BCL2基因mRNA表达量下降,其中加药处理 的10 μM浓度组和100 μM浓度组与对照组之间比 较差异有统计学意义(P<0.05),见图 3。
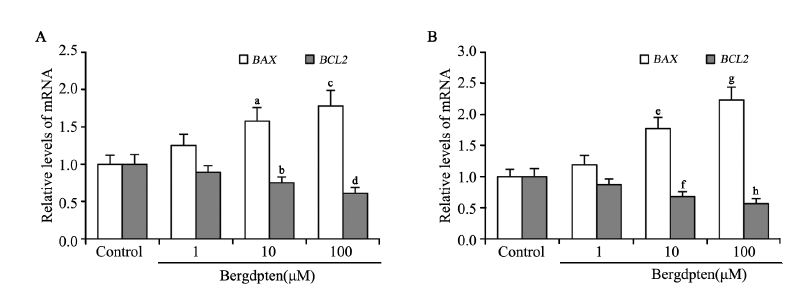
|
| a: P=0.023; b: P=0.009; c: P=0.006; d: P<0.001; e: P=0.010; f: P=0.002; g,h: P<0.001,compared witn control group 图 3 佛手柑内酯作用后CNE-2 (A)和HONE-1(B)细胞的 BCL2家族BAX和BCL2基因的mRNA表达水平 Figure 3 mRNA expressions of BCL2 and BAX in CNE-2(A) and HONE-1(B) cells treated with bergapten |
佛手柑内酯作用48 h后,利用Western blot分析 各组细胞中BAX和BCL2基因的蛋白表达水平,并 利用Quantity One软件进行光密度分析。与mRNA 表达水平的变化趋势相同,随着药物浓度的提 高,BAX基因的蛋白表达水平增高,BCL2基因的 蛋白表达水平降低,两组细胞中100 μM浓度组与 对照组之间的差异均有统计学意义(P<0.05), 见图 4。
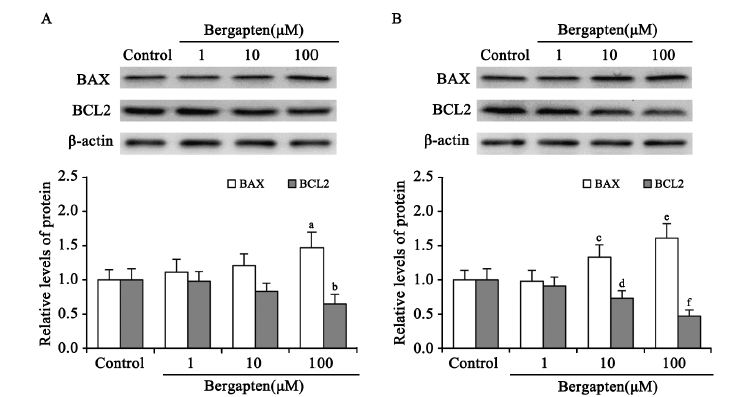
|
| a:P=0.039;b:P=0.034;c:P=0.046;d:P=0.029;e:P=0.013;f:P<0.001,compared with control group 图 4 佛手柑内酯作用后CNE-2 (A)和HONE-1(B)细胞的BCL2家族部分基因的蛋白表达情况 Figure 4 Protein expression of BCL2 and BAX in CNE-2(A) and HONE-1(B) cells treated with bergapten |
佛手柑内酯作用48 h后,利用Western blot分 析各组细胞中信号转导及转录激活因子-3(signal transducers and activators of transcription,STAT3) 蛋白表达水平与p-STAT3 (Y705)的蛋白磷酸 化水平,并利用Quantity One软件进行光密度 分析。各组间STAT的蛋白表达水平基本一致 (P>0.05),而随着药物浓度的提高,p-STAT3 (Y705)的磷酸化水平明显降低,两组细胞中加 药处理的10 μM浓度组和100 μM浓度组与对照组 之间比较差异均具有统计学意义(P<0.05),见 图 5。
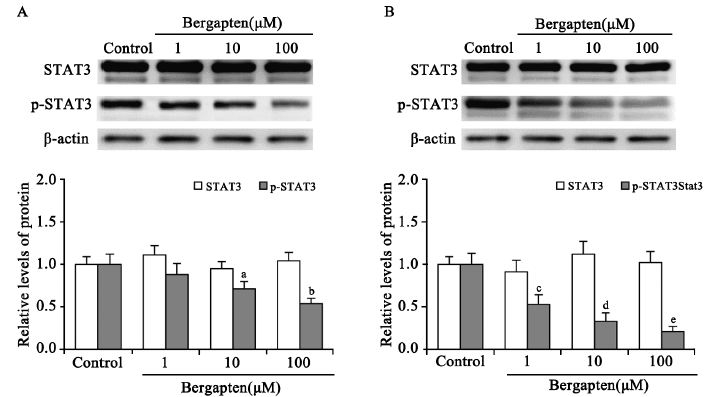
|
| a: P=0.041; b: P=0.01; c: P=0.013; d,e: P<0.001,compared with control group 图 5 佛手柑内酯作用后CNE-2(A) 和HONE-1(B)细胞的STAT3蛋白表达量及磷酸化水平 Figure 5 Protein expression of STAT3 and p-STAT3 (Y705) in CNE-2(A) and HONE-1(B) cells treated with bergapten |
IL-6处理6 h,细胞中BCL2基因的mRNA水 平增加(P<0.05),BAX基因的mRNA水平降低 (P<0.05)。STAT3特异性抑制剂STA-21能显著 抑制IL-6诱导的BCL2基因(P<0.05)转录增加及 BAX基因(P<0.05)转录降低,同样佛手柑内酯也 能显著降低IL-6诱导的BCL2基因(P<0.05)及BAX 基因(P<0.05)的mRNA水平变化,见图 6。
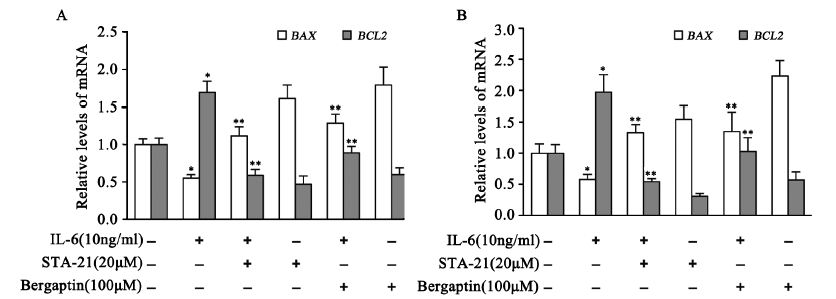
|
| *:P<0.001,compared with control group;**:P<0.001,compared with IL-6 (10ng/ml) group 图 6 佛手柑内酯、STA-21和IL-6对CNE-2(A)和HONE-1(B)细胞中BCL2 和 BAX mRNA的影响 Figure 6 The influence of bergapten,STA-21 and IL-6 on BCL2 and BAX mRNA expression in CNE-2 (A) and HONE-1 (B) cells |
佛手柑内酯因具有平面共轭结构,最早与长波 紫外线(UVA)联用治疗白癜风等皮肤疾病。随后 研究发现佛手柑内酯在UVA的帮助下能与DNA的 腺嘌呤和胸腺嘧啶产生交联的相互作用[6],这种光 毒性能导致DNA的破坏,有诱发皮肤癌的风险[7], 但更为深入的临床研究却表明,佛手柑内酯制成适 合的制剂却具有保护皮肤免受紫外诱导的DNA损 伤[8]。 Lee等[9]研究证实,佛手柑内酯对人肝癌细 胞J5具有明显的体外抑制能力,作用机制可能包 括了直接杀伤作用、阻滞细胞周期作用及诱导细 胞凋亡作用等。这提示我们,佛手柑内酯可以作 为抗癌的天然小分子进行深入的研究,董芳等[4]从 中药北沙参中分离出的佛手柑内酯,在体外抑制 肝癌母细胞与胃癌细胞生长的能力相差甚远,经 换算佛手柑内酯对肝癌母细胞HEP-G2的48 h半数 抑制浓度约为357.1 μM,而对胃癌细胞SGC-7901 的48 h半数抑制浓度约为4.0 μM,显示出不同肿瘤 细胞对佛手柑内酯的敏感度不同。因此,本实验 先利用CCK-8法测算出佛手柑内酯对两种鼻咽癌 细胞的体外抑制活性,其中CNE-2的48 h半数抑制 浓度为(143.7±9.7) μM,HONE-1作用48 h半数抑制浓度为(73.4±7.2) μM,结果显示佛手柑内酯 对鼻咽癌细胞的抑制活性较肝癌细胞好,但仍不 及胃癌细胞,而两种鼻咽癌细胞对佛手柑内酯的 敏感度亦不同,其中HONE-1较CNE-2更为敏感。
凋亡机制的异常与癌症的发生过程密切相 关,诱导癌细胞凋亡更是癌症治疗过程中的重要 机制,对鼻咽癌细胞具有诱导凋亡能力的小分子 化合物可有望成为临床放化疗治疗手段的辅助药 物。本实验利用Annexin V-FITC/PI双染法观察到 佛手柑内酯对低分化的CNE-2和高分化的HONE-1 均有诱导凋亡的作用,凋亡率随药物浓度的增 加而升高。同时,本实验还检测了各组细胞的 Caspase-3活性,结果显示佛手柑内酯能呈浓度依 赖性地增加各组细胞中Caspase-3的活性。活化的 Caspase-3能特异性剪切包括PARP在内的底物蛋 白,参与了染色质固缩、DNA片段化及细胞起泡 等凋亡特征性过程[10],进一步证明了佛手柑内酯 能诱导鼻咽癌细胞凋亡。此外Panno等[11]通过实验 证明,佛手柑内酯能在体外有效抑制乳腺癌细胞 MCF-7和SKBR-3的增殖并诱导其凋亡,其机制与 佛手柑内酯激活caspase-8/-9使细胞DNA片段化并 诱导乳腺癌细胞凋亡有关,可见佛手柑内酯对多 种癌细胞均具有诱导凋亡的能力。
为了进一步阐明佛手柑内酯诱导鼻咽癌细胞 凋亡的相关机制,本实验利用JC-1荧光染料法检 测各组细胞线粒体的膜电位(ΔΨ)情况,结果显 示佛手柑内酯能呈浓度依赖性地降低鼻咽癌细胞 线粒体ΔΨ,表明线粒体膜的功能受损,其通透性 和完整性受到破坏,细胞色素C(cytochrome C) 等多种诱导凋亡的因子可能从线粒体内释放继而 引起细胞的凋亡。BCL2家族蛋白主要通过调节线 粒体的功能来调控细胞的凋亡,其中BCL2蛋白能 与BAX蛋白结合形成异源二聚体,阻碍BAX形成 同源二聚体,避免BAX同源二聚体在线粒体膜上 组成离子通道,保护了线粒体膜电位,并阻止细 胞色素C释放入胞浆所引发的关联Caspase活化[12]。 故我们随后检测了BCL2家族成员中BCL2与BAX 的mRNA及蛋白表达水平,结果显示佛手柑内酯 能降低抑制凋亡的BCL2基因mRNA及蛋白的表达 量,同时增加促进凋亡的BAX基因mRNA及蛋白的 表达量,表明佛手柑内酯可能通过下调BCL2基因 及上调BAX基因破坏线粒体功能继而诱导鼻咽癌细 胞凋亡的发生。
Bose等[13]发现佛手柑内酯能抑制肿瘤坏死因 子-α(tumor necrotic factor-α,TNF-α)和白介素-6 (interleukin-6,IL-6)这两个炎症因子的分泌。其 中IL-6与鼻咽癌的发生发展密切相关,IL-6可以通 过Janus激酶(JAK)磷酸化STAT3蛋白Tyr705及 Ser727位点,使STAT3二聚体化激活入核,增加 BCL2的表达并降低BAX的表达,保护鼻咽癌细胞 免于凋亡[14]。是否佛手柑内酯通过抑制STAT3的活 性而影响了BCL2与BAX的表达?为了回答这一问 题,本实验对各组STAT3的蛋白表达量及p-STAT3 (Y705)的蛋白磷酸化水平进行了检测,结果显示 各组间STAT3的表达量并无显著差异,说明佛手柑 内酯对STAT3的表达量无影响,但p-STAT3 (Y705) 的蛋白磷酸化水平随着佛手柑内酯的含量增加而 降低,表明佛手柑内酯能抑制STAT3蛋白Tyr705的 磷酸化。同样,佛手柑内酯与STAT3选择性抑制剂 STA-21相同,能抑制IL-6诱导的BCL2表达增加及 BAX表达降低,STA-21被Song等[15]证明能特异性 抑制STAT3的激活、抑制乳腺癌细胞的生长并诱导 其凋亡。虽然佛手柑内酯能抑制IL-6激活的STAT3 信号激活,但佛手柑内酯对JAK等激酶是否具有抑 制活性,仍需进一步探索。
在前人的研究基础上发现,佛手柑内酯对鼻 咽癌细胞CNE-2及HONE-1具有较为显著的体外 抑制活性及诱导凋亡能力,其诱导凋亡的机制与 破坏线粒体功能有关,并发现佛手柑内酯增加 BAX的表达及降低BCL2的表达同时抑制p-STAT3 (Y705)的蛋白磷酸化水平,揭示出佛手柑内酯具 备开发成鼻咽癌放化疗辅助药物的潜能,对佛手 柑内酯抗肿瘤机制的更深入研究,将有助于推动 佛手柑内酯在癌症治疗过程中的应用,并为进一 步的结构改造及剂型优化提供重要的理论依据。
| [1] | Loong HH, Ma BB, Leung SF, et al. Prognostic significance of the total dose of cisplatin administered during concurrent chemoradiotherapy in patients with locoregionally advanced nasopharyngeal carcinoma[J]. Radiother Oncol, 2012, 104(3): 300-4. |
| [2] | Chen DX, Zhou TT, Wang JJ, et al. Analysis of characteristic constituents in Fructus Cnidii extracts by RP-HPLC[J]. Yao Xue Shi Jian Za Zhi, 2009, 27(6): 430-3. [陈丹霞, 周婷婷, 王佳静, 等. 蛇床子药材特征成分谱的RP-HPLC分析[J]. 药学实践杂志, 2009, 27(6): 430-3.] |
| [3] | Deng R, Zhang J, Luo WZ, et al. Quantitative determ ination of six coumarins in Angelica dahurica var. formosana by RRLCUV[ J]. Zhongguo Zhong Yao Za Zhi, 2010, 35(23): 3184-7. [邓瑞, 张静, 罗维早, 等. RRLC-UV同时测定川白芷中6种香豆素类成 分的含量[J]. 中国中药杂志,2010,35(23): 3184-7.] |
| [4] | Dong F, Liu HZ, Sun Y, et al. Isolation and identif ication of bergapten in dry root of Glehnia littoralis and preliminary determination of its antitumor activity in vitro[J]. Zhi Wu Zi Yuan Yu Huan Jing Xue Bao, 2010, 19(1): 95-6. 董芳, 刘汉柱, 孙阳, 等. 北沙参中佛手柑内酯的分离鉴定及体外抗肿瘤活性的初步 测定[J]. 植物资源与环境学报, 2010, 19(1): 95-6. |
| [5] | Chen ZX, Lin L. Study on coumarin compounds from exocarpium citri grandis[J]. Zhong Yao Cai,2004,27(8):577-8.[陈志霞,林励.化 橘红药材中香豆素类成分的研究[J].中药材,2004,27(8):577-8.] |
| [6] | da Silva VB, Kawano DF, Carvalho I, et al. Psoralen and bergapten: in silico metabolism and toxicophoric analysis of drugs used to treat vitiligo[J]. J Pharm Pharm Sci, 2009, 12(3): 378-87. |
| [7] | As hwo o d -Smi t h MJ , Po u l t o n GA, Ba r k e r M, e t a l . 5-Methoxypsoralen, an ingredient in several suntan preparations, has lethal, mutagenic and clastogenic properties[J]. Nature, 1980, 285(5764): 407-9. |
| [8] | Potten CS, Chadwick CA, Cohen AJ, et al. DNA damage in UVirradiated human skin in vivo: automated direct measurement by image analysis (thymine dimers) compared with indirect measurement (unscheduled DNA synthesis) and protection by 5-methoxypsoralen[J]. Int J Radiat Biol, 1993, 63(3): 313-24. |
| [9] | Lee YM, Wu TH, Chen SF, et al. Effect of 5-methoxypsoralen (5-MOP) on cell apoptosis and cell cycle in human hepatocellular carcinoma cell line[J]. Toxicol In Vitro, 2003, 17(3): 279-87. |
| [10] | Wang ZH, Liang T, Li T, et al. Effect of chrysin in inhibiting proliferation of human nasopharyngeal carcinoma cell line CNE- 2[J]. Zhongguo Yao Ke Da Xue Xue Bao, 2013, 44(1): 93-6. [王 铮华, 梁统, 李涛, 等. 白杨素对人鼻咽癌细胞CNE-2增殖的抑 制作用[J]. 中国药科大学学报, 2013, 44(1): 93-6.] |
| [11] | Panno ML, Giordano F, Palma MG, et al. Evidence that bergapten, independently of its photoactivation, enhances p53 gene expression and induces apoptosis in human breast cancer cells[J]. Curr Cancer Drug Targets, 2009, 9(4): 469-81. |
| [12] | Fan DS, Zhen L, Sun N. Effect of curcumin on proliferation and apoptosis of human nasopharyngeal carcinoma cne-2z cells[J]. Zhong Liu Fang Zhi Yan Jiu, 2011, 38(3): 254-6. [范德生, 甄蕾, 孙宁. 姜黄素对人鼻咽癌CNE-2Z细胞增殖及凋亡的影响 [J]. 肿瘤防治研究, 2011, 38(3): 254-6.] |
| [13] | Bose SK, Dewanjee S, Sahu R, et al. Effect of bergapten from Heracleum nepalense root on production of proinflammatory cytokines[J]. Nat Prod Res, 2011, 25(15): 1444-9. |
| [14] | Liao Q, Zeng Z, Guo X, et al. LPLUNC1 suppresses IL-6-induced nasopharyngeal carcinoma cell proliferation via inhibiting the Stat3 activation[J]. Oncogene, 2013, 33(16): 2098-109. |
| [15] | Song H, Wang R, Wang S, et al. A low-molecular-weight compound discovered through virtual database screening inhibits Stat3 function in breast cancer cells[J]. Proc Natl Acad Sci U S A, 2005, 102(13): 4700-5. |
 2014, Vol. 41
2014, Vol. 41



