文章信息
- 王勇,高烨,徐军,朱玉方,周士振,陶荣杰. 2014.
- WANG Yong, GAO Ye, XU Jun, ZHU Yufang, ZHOU Shizhen, TAO Rongjie. 2014.
- 贝伐单抗一线治疗胶质母细胞瘤的Meta分析
- Bevacizumab as First-line Therapy for Glioblastoma: A Meta-analysis
- 肿瘤防治研究, 2014, 41(10): 1098-1101
- Cancer Research on Prevention and Treatment, 2014, 41 (09): 1098-1101
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.10.002
-
文章历史
- 收稿日期:2013-07-31
- 修回日期:2013-10-30
胶质母细胞瘤是颅内常见的原发恶性肿瘤, 病程短、进展快、死亡率高。目前临床上采用手 术为主,术后辅助放化疗的综合治疗措施,但疗 效仍然不理想,复发率高、预后差,2年中位生 存期也仅为27.2%[1]。研究表明血管内皮生长因子 (vascular endothelial growth factor,VEGF)过度表 达与胶质瘤血管生成及侵袭有关,因此针对VEGF 的抗血管生成靶向治疗成为肿瘤治疗中的一种重 要手段[2]。贝伐单抗(Bevacizumab)作为第一个抑制 肿瘤血管生成的靶向药物,已广泛应用于复发性 胶质母细胞瘤的治疗,然而一直以来贝伐单抗是 否可以用于治疗新诊断的胶质母细胞瘤却充满争 议[3]。直至2013年5月份公布的贝伐单抗联合标准 放化疗治疗胶质母细胞瘤的Ⅲ期随机临床试验提 示,贝伐单抗可延长无进展生存期,但并不能改 善患者的总生存期,目前这一观点已得到了绝大多数学者的认可。既然单独增加贝伐单抗作用有 限,是否可以再此基础上增加其他药物联合治疗 以提高疗效呢?本文基于此疑问,就目前研究现 状对已发表的文献进行Meta分析,以便为临床应 用及研究提供线索。 1 资料与方法 1.1 文献纳入与排除标准
文献纳入标准:研究类型为临床试验(Ⅱ或Ⅲ 期)。研究对象为应用贝伐单抗多药联合治疗的新 诊断的胶质母细胞瘤患者。每项研究患者数需大 于10例,有完整的生存数据。文献排除标准:排 除动物实验、机制研究、重复发表、个案报道及 综述等文献。 1.2 文献检索策略
2计算机检索PubMed、Embase、Cochrane图 书馆、中国期刊全文数据库CNKI及中国生物医 学文献数据库并结合手工检索。检索时间均为建 库至2013年7月。英文检索词为:bevacizumab、 avastin、newlydiagnosed、first-line、glioblastoma、GBM;中文检索词为:贝伐单抗、 阿瓦斯汀、新诊断、一线、胶质母细胞瘤。严格 按照文献纳入和排除标准筛选文献,筛选所得文 献由2名评价员独立提取资料并交叉核对,确保文 献提取和质量分析结果具有一致性。 1.3 数据提取与分析
应用Engauge Digitizer V4.1对生存曲线进行数 据提取,采用MetaAnalyst Beta 3.13行单组研究数 据的Meta分析,计算合并效应量及95%可信区间 1.4 统计学方法
应用Engauge Digitizer V4.1对生存曲线进行数 据提取,采用MetaAnalyst Beta 3.13行单组研究数 据的Meta分析,计算合并效应量及95%可信区间(CI),通过比较两组之间95%CI是否有重叠,来 计算不同治疗组之间无进展生存期(PFS)和总生 存率(OS)的差异。若95%CI不重叠则存在显著 性差异,反之则不存在显著性差异。 2 结果 2.1 文献检索结果
术初检出相关文献78篇,均为英文文献。依据 纳入和排除标准,最终12篇文献纳入Meta分析, 均为Ⅱ期临床单臂随机非对照试验,发表于2010 年—2013年;累及样本量837例,2名评价员在文 献原始数据提取上取得一致,见表 1。
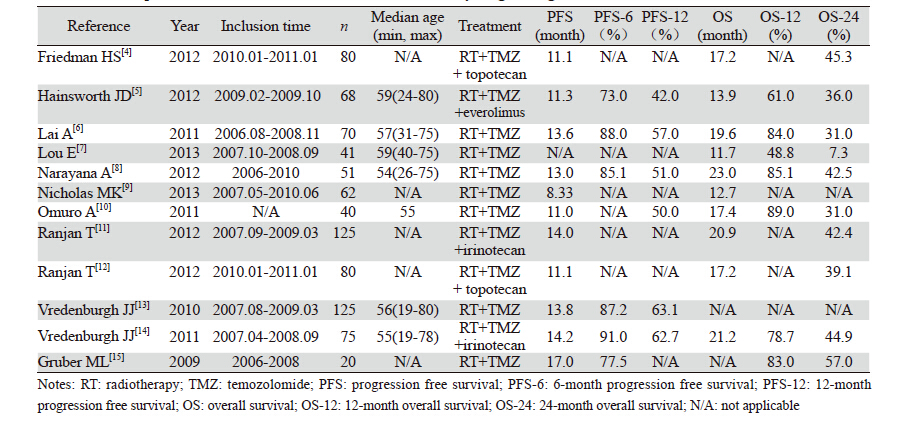 |
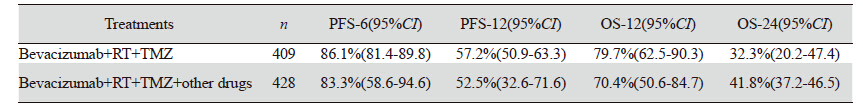
12项Ⅱ期临床试验数据汇总结果显示:中位 年龄在54~59岁之间(19~80岁),贝伐单抗剂 量均为10 mg/kg,每两周给药一次,联合替莫唑 胺,28天为一周期,平均化疗5.7周期。7项Ⅱ期 临床试验应用贝伐单抗联合标准治疗方案(放疗 +替莫唑胺),其余5项临床研究在此基础上联合 其他药物(拓扑替康、伊立替康、依维莫司)。 中位PFS在8.33~17月之间(平均12.6月),中位生 存期在11.7~23月之间(平均17.5月)。应用Meta- Analyst对单组研究数据进行数据合并,其结果显 示:6月的PFS为84.5%(95%CI:78.1~89.3),12 月的PFS为55.1%(95%CI:48.0~61.9),12月的 OS为76.0%(95%CI:62.5~85.7),24月的OS为 38.4%(95%CI:32.5~44.7)。根据联合使用药物 的不同分为:贝伐单抗联合RT+TMZ组与在此基 础上增加其他药物组。两组患者PFS及OS 95%CI均有重叠,提示不同治疗组之间无显著性差异, 即在贝伐单抗联合RT+TMZ基础上增加其他用药 并不能增加患者的PFS和OS,见表 2。
 |
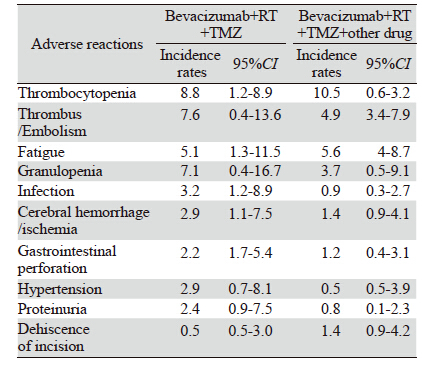
针对12项Ⅱ期临床试验Ⅲ/Ⅳ级不良反应及并 发症情况的荟萃分析显示:所纳入的837例患者共 出现各类并发症24种,共计351例不良反应及并发 症。常见的不良反应及并发症主要为:血小板减 少、血栓/栓塞、疲劳、粒细胞减少、感染、脑出 血/缺血、胃肠道穿孔、高血压、刀口裂开等。荟 萃分析结果显示:不同治疗组不良反应之间95% CI均有重叠,提示不同治疗组不良反应之间无显 著性差异,见表 3。
贝伐单抗是一种重组的人源化IgG1单克隆抗 体,半衰期为17~21天。体内、体外实验证实IgG1 抗体能与人血管内皮生长因子结合并阻断其生物 活性。贝伐单抗包含了约93%人源抗体的结构区 和7%可结合VEGF的鼠源单抗的互补决定区,可 选择性结合阻止其与内皮细胞表面的受体结合, 抑制肿瘤血管的生成,从而发挥抗肿瘤作用。胶质 母细胞瘤血管增生活跃,并产生大量的VEFG。贝 伐单抗通过与VEGF结合,阻断其与对应的受体结合,抑制肿瘤血管的形成,从而抑制肿瘤生长[2,16]。
2004年2月贝伐单抗获得FDA的批准,是美国 第一个获得批准上市的抑制肿瘤血管生成的靶向 药物,作为单药或联合化疗药物用于转移性结肠 癌、肺癌、直肠癌、乳腺癌等多种恶性肿瘤的治 疗。基于AVF3708g和NCI 06-C-0064E两项Ⅱ期临 床试验研究的结果,美国FDA于2009年5月9日首 次批准贝伐单抗用于胶质母细胞瘤,但只用于复 发性胶质母细胞瘤,而不是在初诊患者[2]。2013 年日本卫生、劳动与福利部首次批准贝伐单抗应 用于新诊断的胶质母细胞瘤,然而在美国临床肿 瘤学会(ASCO)2013年年会上,公布的一项标准 一线放化疗联合贝伐珠单抗来治疗胶质母细胞瘤 的Ⅲ期随机临床试验显示,虽然增加贝伐单抗能 够适当延长患者的无进展生存期,但并不能改善 患者的总生存期。而且与单独应用放化疗相比, 接受贝伐珠单抗治疗的患者会产生更多的不良反 应。因此贝伐单抗是否可以批准用于治疗新诊断 的胶质母细胞瘤仍然充满争议性。既然单独增加 贝伐单抗作用有限,是否可以增加其他药物联合 治疗以提高疗效?
目前NCCN指南及中国版共识都强烈推荐采用 放疗联合同步和辅助替莫唑胺化疗治疗胶质母细 胞瘤患者。然而替莫唑胺化疗仍然有其局限性, MGMT是一项较为肯定的与恶性胶质瘤对亚硝基 脲类和替莫唑胺耐药相关的指标,它能够将DNA 鸟嘌呤六号氧上的烷基转移到自身的半胱氨酸残 基上,使DNA上烷基化的鸟嘌呤被还原,自身则 变成失活的烷基化MGMT,从而利于化疗药物发挥 作用。然而约55%~65%的患者MGMT表达阴性, 这使得替莫唑胺标准方案治疗效果仍不理想[17, 18]。 因此其他药物的联合似乎仍然有其必要性。
本研究共纳入837例胶质母细胞瘤患者,其中 贝伐单抗联合标准放化疗组409例患者,在此基础 上增加其他化疗药物治疗的患者428例,对两组患 者的6月无进展生存率、12月无进展生存率、1年 生存率和2年生存率的95%CI进行重叠性分析显示 均无显著性差异。即表明贝伐单抗联合RT+TMZ 基础上增加其他药物治疗并不能增加患者的PFS和 OS。同时我们还利用Meta-Analyst Beta 3.13软件对贝伐单抗在联合治疗中的不良反应进行了系统评 价,结果显示常见的不良反应为:血小板减少、 血栓/栓塞、疲劳、粒细胞减少、感染、胃肠道 穿孔、高血压、脑出血、刀口裂开、脑缺血等。 与贝伐单抗治疗其他系统的肿瘤所产生的不良反 应相比脑卒中(脑出血和脑缺血)的发生率明显 提高。血小板减少、疲劳以及粒细胞减少等不良 反应的发生多与替莫唑胺等烷化剂的联合应用有 关,荟萃分析结果显示不同治疗组不良反应之间 无显著差异。
本系统评价的局限性:(1)纳入文献全部为 Ⅱ期临床试验,文献缺乏对照故异质性大,其结 论尚需未来Ⅲ期临床试验来验证。(2)纳入的资 料均为已发表文献,最新的ASCO会议报到的部分 临床试验因尚未发表,故未能纳入,对文章结论 的说服力造成一定影响。(3)由于本研究纳入文 献研究均为英文,存在一定的发表偏倚。因此本 文结论应谨慎看待。
综上所述,贝伐单抗在联合标准的放化疗方 案的基础上增加其他药物尚不能提高患者的无进 展生存期和总生存期。贝伐单抗多药联合治疗新 诊断的胶质母细胞瘤较治疗其他系统的肿瘤相比 脑卒中的发生率较高。但由于所纳入研究质量不 高,需要开展严格设计的大样本、随机双盲对照 的Ⅲ期临床试验来进一步证实。
| [1] | Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy al one on survival in glioblastoma in a randomised phase Ⅲ study: 5-year analysis of the EORTC-NCIC trial[J]. Lancet Oncol, 2009, 10(5): 459-66. |
| [2] | Gil-Gil MJ, Mesia C, Rey M, et al. Bevacizumab for the treatment of glioblastoma[J]. Clin Med Insights Oncol, 2013, 7: 123-35. |
| [3] | Piccioni D,Lai A,Nghiemphu P, et al. Bevacizumab as firstline therapy for glioblastoma[J]. Future Oncol, 2012, 8(8): 929-38. |
| [4] | Friedman HS, Desjardins A, Peters KB, et al. The addition of bevacizumab to temozolomide and radiation therapy followed by bevacizumab, temozolomide, and oral topotecan for newly diagnosed glioblastoma multiforme (GBM)[J]. J Clin Oncol, 2012, 30(1): 15-6. |
| [5] | Hainsworth JD, Shih KC, Shepard GC, et al. Phase Ⅱ study of concurrent radiation therapy, temozolomide, and bevacizumab followed by bevacizumab/everolimus as first-line treatment for patients with glioblastoma[J]. Clin Adv Hematol Oncol, 2012, 10(4): 240-6. |
| [6] | Lai A, Tran A, Nghiemphu PL, et al. Phase Ⅱ study of bevacizumab plus temozolomide during and after radiation therapy forpatients with newly diagnosed glioblastoma multiforme[J]. J Clin Oncol, 2011, 29(2): 142-8. |
| [7] | Lou E, Peters KB, Sumrall AL, et al. Phase Ⅱ trial of upfront bevacizumab and temozolomide for unresectable or multifocalgli oblastoma[J]. Cancer Med, 2013, 2(2): 185-95. |
| [8] | Narayana A, Gruber D, Kunnakkat S, et al. A clinical trial of b evacizumab, temozolomide, and radiation for newly diagnosed glioblastoma[J]. J Neurosurg, 2012, 116(2): 341-5. |
| [9] | Nicholas MK, Chmura S, paleologos N, et al. Avastin and temozolomide following radiation and chemotherapy for newly diagnosed glioblastoma: results of a phase Ⅱstudy[J]. Neuro- Oncology 2011, 13(3): 88-9. |
| [10] | Omuro AMP, Beal K, Karimi S, et al. Phase Ⅱ study of bevacizumab(BEV), temozolomide(TMZ), and hypofractionated stereotactic radiotherapy (HFSRT) for newly diagnosed glioblastoma(GBM)[J]. J Clin Oncol, 2011, 13(3): 59-60. |
| [11] | Ranjan T, Desjardins A, Peters KB, et al. Long-term follow-up of a phase Ⅱ trial of upfront bevacizumab with temozolomide and radiation therapy followed by bevacizumab,temozolomide, and irinotecan for newly diagnosed glioblastoma multiforme (GBM)[J]. Neuro-Oncology, 2012, 14: 81-2. |
| [12] | Ranjan T, Desjardins A, Peters KB, et al. Phase II trial of upfront bevacizumab with temozolomide and radiation therapy followed by bevacizumab, temozolomide and oral topotecan for newly diagnosed glioblastoma multiforme (GBM)[J]. Neuro-Oncology, 2012, 14: 79-80. |
| [13] | Vredenburgh JJ, Desjardins A, Kirkpatrick JP, et al. Addition of bevacizumab to standard radiation therapy and daily temozolomide is associated with minimal toxicity in newly diagnosed glioblastoma multiforme[J]. Int J Radiat Oncol Biol Phys, 2012, 82(1): 58-66. |
| [14] | Vredenburgh JJ, Desjardins A, Reardon DA, et al. The addition of bevacizumab to standard radiation therapy and temozolomide followed by bevacizumab, temozolomide, and irinotecan for newly diagnosed glioblastoma[J]. Clin Cancer Res, 2011, 17(12): 4119-24. |
| [15] | Gruber ML, Raza S, Gruber D, et al. Bevacizumab in combination with radiotherapy plus concomitant and adjuvant temozolomide for newly diagnosed glioblastoma: Update progression- free survival, overall survival, and toxicity[J]. J Clin Oncol, 2009, 27(Suppl 1): S15. |
| [16] | Chen WF, Mo LG, Wu QL. Current progression of bevacizumab in treatment of recurrent glioblastoma[J]. Zhongguo Shen Jing Zhong Liu Za Zhi, 2012, 10(2): 117-20. [陈卫峰, 莫立根, 吴倩岚. 贝伐单抗治疗复发性胶质母细胞瘤的研究进展[J]. 中国神经肿 瘤杂志, 2012, 10(2): 117-20.] |
| [17] | Chahal M, Abdulkarim B, Xu Y, et al. O6-Methylguanine-DNA methyltransferase is a novel negative effector of invasion in glioblastoma multiforme[J]. Mol Cancer Ther, 2012, 11(11): 2440-50. |
| [18] | Yan Y, Tang WY, Deng ZX. Efficacy of temozolomide in treatment of recurrent glioma[J]. Zhong Liu Fang Zhi Yan Jiu, 2010, 37(1): 91-4. [晏怡, 唐文渊, 邓朝霞. 替莫唑胺治疗复发性胶质瘤的疗 效分析[J]. 肿瘤防治研究, 2010, 37(1): 91-4.] |
 2014, Vol. 41
2014, Vol. 41