文章信息
- 邓玉洁,陈晓辉,林学德,施烯,曾乌查,郑敏. 2014.
- DENG Yujie, CHEN Xiaohui, LIN Xuede, SHI Xi, ZENG Wucha, ZHENG Min. 2014.
- 胃高度恶性神经内分泌肿瘤的临床病理特征及预后分析
- Clinicopathological Characteristics and Prognosis of 50 Patients with High-grade Gastric Neuroendocrine Malignancies
- 肿瘤防治研究, 2014, 41(10): 1093-1097
- Cancer Research on Prevention and Treatment, 2014, 41 (09): 1093-1097
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.09.002
-
文章历史
- 收稿日期:2014-04-30
- 修回日期:2014-07-25
神经内分泌肿瘤(neuroendocrine neoplasms, NENs)是一组起源于肽能神经元和神经内分泌 细胞的异质性肿瘤,可发生于全身许多器官及组织,如肺、食管、胃肠、胰腺等[1]。胃肠道 神经内分泌肿瘤(gastrointestinal neuroendocrine neoplasms,GINEN)是起源于消化道的胺前体摄 取与脱羧酶(amine precursor uptake decarbosylase, APUD)细胞的异质性肿瘤,临床较少见[1]。长 期以来,GINEN分类混乱,无法准确地反映肿 瘤的起源、激素分化活性及生物学行为。2010 年WHO消化系统肿瘤分类对神经内分泌肿瘤 的命名和分类作了修订,将其分为神经内分泌 瘤(neuroendocrine tumor,NET)、神经内分泌 癌(neuroendocrine carcinoma,NEC)、混合性 腺神经内分泌癌(mixed adenoneuroendocrine carcinoma,MANEC)以及增生性及瘤前病变[2]。胃 神经内分泌肿瘤(gastric neuroendocrine neoplasms, G-NENs)约占所有神经内分泌肿瘤的6%,其发 病率约为2/100万[1, 2]。而胃高度恶性神经内分泌 肿瘤被定义为高级别的神经内分泌肿瘤,由于它 的高度侵袭性生物学行为与极差的临床预后而被 单独归类,一般包括G-NECs与G-MANECs。高 度恶性的NECs及MANECs发病率低、预后差[3], 目前认为完全切除肿瘤是根治的前提,但影响患 者术后生存的因素尚不清楚。本文回顾性分析50 例胃高度恶性神经内分泌肿瘤(包括G-NEC及 G-MANEC)患者的临床资料,通过分析其临床病 理特征及免疫组织化学染色,探讨其临床病理特 征及影响预后的可能因素。 1 资料与方法 1.1 临床资料
收集2009年2月至2013年8月福建医科大学附 属第一医院化疗科经病理确诊的50例胃高度恶性 神经内分泌肿瘤(包括G-NEC与G-MANEC)患者, 按2010年WHO诊断标准,通过观察光学显微镜下 形态学、病理学特征及结合免疫组织化学检查, 分析该50例患者的病理特点及形态学、免疫组织 化学特征和预后关系。主要临床病理特征如下: 平均年龄63岁(47~82岁);男37例(74%), 女13例(26%);NEC44例(大细胞型8例,小 细胞型27例,混合型9例,分别占总数的16%、 54%及18%),MANEC6例(其中混合性腺癌-大 细胞4例,混合性腺癌-小细胞2例,分别占总数 的8%与4%),本组6例MANEC中均无混合性腺 癌-NET1/2级病例。 1.2 标本制作及免疫组织化学染色
所有病理标本均经10%福尔马林固定,常规脱 水,石蜡包埋,4 μm厚连续切片,HE染色,光学显微镜下进行形态学观察。采用Dako Envision二 步法免疫组织化学染色,检测的抗体包括突触素 (synaptophysin,Syn)、 嗜铬素(chromogranin, CgA)、 CD56、抗体均购自中山公司,染色步骤 按产品说明书程序操作,每批实验均同时设阴性 和空白对照,免疫组织化学染色定位于肿瘤细胞 胞质,阳性染色定义为每10个高倍镜视野细胞计 数≥20%肿瘤细胞胞质内出现棕黄色颗粒。 1.3 诊断标准
2010年WHO分类[4, 5, 6]GEP-NEN分为5大类 (1)神经内分泌肿瘤(包括类癌),低度恶性 (neuroendocrine neoplasm,low grade,G1),核 分裂相<2个/10 HPF,Ki-67增殖指数<3%。(2) 神经内分泌肿瘤,中度恶性(neuroendocrine neoplasm,intermediate grade,G2),核分裂相 为2~20个/10 HPF或Ki-67增殖指数为3%~20%。 (3)神经内分泌癌,高度恶性(neuroendocrine carcinoma,high grade,G3),核分裂相>20个/10 HPF 或Ki-67增殖指数>20%。NEC分为3个组织学 亚型[7, 8]:小细胞癌:肿瘤细胞通常小于3个静止淋 巴细胞,呈圆卵圆或梭形,胞质稀少,核染色质 细颗粒状;大细胞癌:弥漫性生长方式或显示内 分泌结构(器官样、栅栏状、玫瑰花环等),胞 质量中等丰富,泡状核,核仁明显;混合型神经 内分泌癌(mixed NEC):介于小大细胞癌之间 的组织学特征,胞质比小细胞癌更多些,核仁更 明显,核质比轻微增高。(4)混合性腺神经内分 泌癌,同时含有腺管样上皮和神经内分泌细胞, 两组成分均具恶性潜能,每一组成分至少要超过 30%。(5)增生性和瘤前病变(hyperplastic and preneoplastic lesion)。 1.4 统计学方法
应用SPSS 1 9 . 0统计软件进行分析,采用 Kaplan-Meier法进行生存分析并绘制生存曲线,组 间生存率比较采用Log rank检验,P<0.05认为差异 有统计学意义。 2 结果 2.1 组织学及免疫组织化学染色结果
50例病例中G-NEC占44/50,常见大细胞癌 (8/50)呈巢状生长,瘤细胞较大,胞质量中等 到丰富,核仁明显,见图 1A;小细胞癌(27/50) 呈弥漫性生长,细胞排列致密,可见器官样结 构、粗梁状排列;瘤细胞通常小于3个静止淋巴细 胞,缺少胞质,具有圆形、卵圆形或梭形的核,见图 1B;混合型比大细胞癌略多见(9/50),有 类似于小细胞癌细胞学特征,缺乏明显的细胞界 限,胞质略多,泡状核及核仁的特征比小细胞癌 明显,有的区域细胞间变特征明显,胞质透明 或明显嗜酸性,可见小管结构及胞质内黏液; G-MANEC(6/50)较罕见,图 1C所示为一大细胞 癌合并腺样结构的MANEC,图片左侧可见形态学 上可识别的腺上皮,右侧为大细胞神经内分泌细 胞的两种成分的恶性肿瘤。50例标本中Syn染色阳 性49例(98%)、CgA染色阳性24例(48%)。图 1D、1E分别为小细胞NEC的CgA、Syn免疫组织化 学阳性染色,CD56染色阳性19例(38%),合并 慢性胃炎及肠化生者分别为13(26%)例和34例 (68%)。
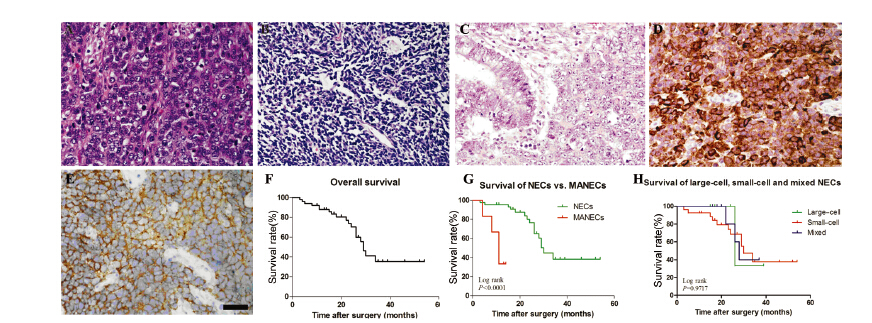
|
| A:large-cell NEC; B:small-cell NEC;C:MANEC; D:CgA for small-cell NEC; E:Syn for small-cell NEC (scale bar = 20 μm,×400); F:overall survival curve for 50 high-grade neuroendocrine malignancies; G:Kaplan-Meier survival curve of NEC and MANEC; Log-rank test indicated that there was significant difference of their survival time(P<0.001); H:survival curves for large-cell,small-cell and mixed NECs; Log-rank test indicated that there was no significant difference of their survival time(P=0.9717) 图 1 不同类型的高度恶性神经内分泌肿瘤的HE染色与免疫组化染色以及G-NEC与G-MANEC的生存分析 Figure 1 HE and IHC staining of various high-grade neuroendocrine malignancies and survival analysis of G-NECs and G-MANECs |
50例患者均行手术治疗。根据肿瘤部位及浸 润范围选择手术方式,其中根治性远端胃大部切 除23例、根治性全胃切除14例、根治性近端胃大 部切除11例、根治性远端胃大部切除+肝转移灶切 除1例、根治性全胃切除+部分胰体尾切除+脾切除 术1例。其中16例未接受化疗;34例患者接受术后 辅助化疗,具体方案为:奥沙利铂联合氟尿嘧啶 及亚叶酸钙(FOLFOX4)18例、紫杉醇联合奥沙 利铂及氟尿嘧啶5例、紫杉醇联合替加氟4例、奥 沙利铂联合卡培他滨(XELOX)4例、伊立替康 联合氟尿嘧啶及亚叶酸钙(FOLFIRI)2例、氟尿 嘧啶联合表阿霉素及达卡巴嗪1例。其中一例使用 氟尿嘧啶联合表阿霉素及达卡巴嗪化疗4周期后局 部进展,改依托泊苷加顺铂(EP)方案化疗6周 期,再次进展又使用FOLFIRI化疗3周期。所有患 者均未行放疗。术后通过门诊复查、信件及电话 等方式进行观察和随访,随访期为自手术日至末 次随访日或患者死亡时,随访截至2013年12月31 日。随访指标为患者的临床症状、实验室和影像 学检查以及患者的生存情况。本组50例患者均获 随访,随访时间最长54月,最短3月,中位生存期 为29月,见图 1F,50例患者的1、2、3年生存率分 别为84%、44%和10%。G-NEC和G-MANEC的中 位生存时间分别为30月及11月,生存曲线显示两 者者之间差异有统计学意义,见图 1G(Log rank检 验,P<0.0001)。而G-NEC的Kaplan-Meier生存曲 线显示,3个组织学亚型的生存时间差异无统计学 意义,见图 1H(Log rank检验,P=0.9717)。 2.3 影响胃神经内分泌癌患者的预后因素
50例胃高度恶性神经内分泌肿瘤患者中, 肿瘤大于5 cm的11例;局限于黏膜或固有肌层 者6例,44例浸润肌层或达浆膜外周围组织; 伴淋巴结转移3 9 例; 伴肝转移者2 2 例,6 例 G-MANEC均有肝转移。组织学类型与肝转移有关 (P=0.005),而与肿瘤大小、浸润深度、淋巴结 转移、慢性胃炎及肠化生等无关(P均>0.05), 见表 1。
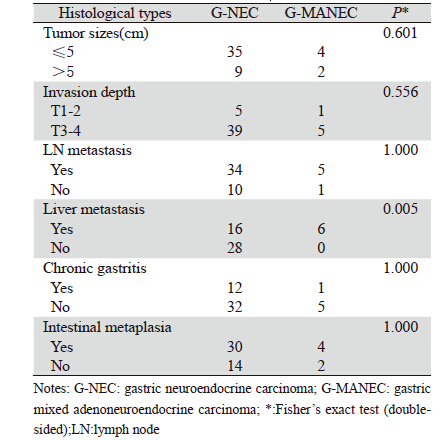 |
本文观察了G-NECs及G-MANECs的临床病 理学特征,并对可能影响预后的相关因素进行分析,发现50例标本中Syn染色阳性49例(98%)、 CgA染色阳性24例(48%)、CD56染色阳性19 例(38%)。此外,不同的细胞类型如小细胞型 NEC、大细胞型NEC及混合型G-NEC在生存方面 没有明显的统计学差异(P=0.9717),而G-NECs 与G-MANECs的生存时间则存在明显的差别,结 果显示MANECs更容易出现肝脏转移,预后更差 (P<0.0001)。
随着对G-NENs生物学行为及分子病理机制的 深入研究,NENs被认为是一组包括从惰性生长、 低度恶性到明显恶性的具有高度异质性的肿瘤[9]。 WHO2010年第4版新分类方法进一步完善了以往的 分类系统,并提出除了体积较小(﹤5 mm) 的微 腺瘤以外,消化系统神经内分泌肿瘤均视为恶性 肿瘤,并采纳欧洲神经内分泌肿瘤学会(European Neuroendocrine Tumor Society,ENETS)提出的分 级和TNM分期方法[4]。该分类方法将肿瘤的分级 与分期信息分开,能更加清晰、准确地反映肿瘤 的病理类型及生物学行为,本研究正是应用上述 标准作为分类和研究的基础。
应用相同的分类方法,叶郁红等[10]分析了90 例胃肠道神经内分泌肿瘤的病理学特征,其中 的59例为G-NECs,5例G-MANECs,结果提示 G-NECs的2年生存率为35%,与本文的44%相近, 且不同亚组G-NECs的生存时间未见明显异常, 与本文结果相一致;遗憾的是,该文并未进一步 分析G-NEC与G-MANEC的生存率差别。2013年 Ishida等[11]报道了51例G-NEC的形态学、免疫组织 化学及预后因素分析,无论是单变量还是多变量 分析均提示G-NEC与G-MANEC的组织学差异对 生存时间并无影响,Kaplan-Meier生存分析提示两 种不同组织学的患者生存时间差异并无统计学意 义。而本文的结果则显示G-MANEC较G-NEC患者 更容易出现远处(如肝脏)的转移,临床预后更 差。究其原因,可能是由于G-MANEC的生物学行 为很大程度上取决于肿瘤组织中异型明显的细胞 类型[12],而本文的G-MANEC生存期短可能与合并 低分化腺癌成分有关,还可能与本组G-MANEC患 者入组时均存在肝转移有关,且本研究为单中心 回顾性分析,入组的样本量相对有限,可能存在 一定的统计偏倚,因此本结果还需要后续大样本 量的研究进行进一步证实。
免疫组织化学在神经内分泌肿瘤的诊断和鉴 别诊断中起着十分重要的作用。突触素(Syn) 和嗜铬粒素(CgA )是针对NEN诊断与鉴别特异 性、敏感度均较强的分子标志物。Syn是由X染色 体上SYP基因编码的相对分子质量为3.8×104的一 种突触囊泡糖蛋白,存在于人体所有神经内分泌 细胞。绝大多数G-NEN瘤细胞弥漫表达Syn。由于 所有神经元细胞都参与Syn的呈递,因此神经元细 胞和部分神经细胞也表达Syn,此外部分非NEN瘤 细胞(如胰腺实性假乳头状肿瘤)也可以显示阳 性。CgA位于神经元和神经内分泌细胞的分泌囊泡 内,不是所有神经内分泌细胞均含此类分泌囊泡, 不同神经内分泌细胞所含囊泡数量也不同[13, 14]。因 此,CgA在不同部位、不同分化的G-NEN中的表 达有所不同。例如发生在直肠和阑尾的G-NEN以 及十二指肠的生长抑素瘤一般不表达CgA,肺小 细胞癌常弱表达或不表达CgA。在低分化G-NENs 常表现为CgA 阴性,而Syn的产生不依赖于神经内 分泌颗粒的形成,对低分化的G-NENs可能更为有 用,因此CgA和Syn联合使用作为一线标志物较合 适[11,15],两者合用可以诊断96%的G-NECs,并可 利用CD56作为辅助性诊断指标[11],本文50例标本 中Syn 阳性率为98%、CgA为48%、CD56为38%, 诊断依据确凿,另外,通过单变量分析均未发现 各项IHC指标与生存时间存在关联。
对于神经内分泌肿瘤术后生存情况的预测,目 前较明确的依据是肿瘤的生物学特征[16]。Carcia- Carbonero等[17]的研究显示GINEN5年生存率为75.4%,在本研究中因随访时间限制尚无5年生存数 据,3年生存率仅10%,3种NEC组织学亚型生存 时间无显著性差异,而G-NEC与G-MANEC生存曲 线显示两者之间有显著性差异,提示胃高度恶性 神经内分泌肿瘤生存率低,其中G-MANEC预后更 差,这与国内黄治国等[18]认为混合性腺神经内分 泌癌生存期最短研究一致。
由于胃高度恶性神经内分泌肿瘤发病率较低 以及肿瘤的高度异质性,对手术治疗后的患者预 后分析极为有限[17]。为有利于评价肿瘤的预后,欧洲 神经内分泌肿瘤学会还依据肿瘤的细胞学特性或体 积、淋巴结和转移灶对NEN行TNM分期[14]。在本研究 结果中:肝转移与组织学分类有关(P=0.005); 44例浸润深度达到或超过肌层;39例伴淋巴结转 移,后两者及肿瘤大小等病理因素与组织学类型 无关,有无合并慢性胃炎及肠化生跟胃高度恶性 神经内分泌肿瘤组织学类型亦无关,推导此类病 理变化可能并不提示预后。但该结论同样也存在 样本量小及混杂因素的局限性。
综上所述,胃高度恶性神经内分泌肿瘤增殖 活性及恶性程度高,治疗效果不佳,与G-NEC相 比,G-MANEC更容易发生肝脏及远处器官转移, 预后更差。因此诊断过程中应该注重胃高度恶性 神经内分泌肿瘤的病理分型,并加强随访。
| [1] | Oberg K. Neuroendocrine tumors (NETs): historical overview and epidemiology[J]. Tumori, 2010, 96(5): 797-801. |
| [2] | Niederle MB, Hackl M, Kaserer K,et al. Gastroenteropancreatic neuroendocrine tumours: the current incidence and staging based on the WHO and European Neuroendocrine Tumour Society classification: an analysis based on prospectively collected parameters[J]. Endocr Relat Cancer, 2010, 17(4): 909-18. |
| [3] | Delle Fave G, Kwekkeboom DJ, Van Cutsem E, et al. ENETS Consensus Guidelines for the management of patients with gastroduodenal neoplasms[J]. Neuroendocrinology, 2012, 95(2): 74-87. |
| [4] | Rindi G. The ENETS guidelines: the new TNM classification system[J]. Tumori, 2010, 96(5): 806-9. |
| [5] | Oberg K, Akerstr?m G, Rindi G, et al. Neuroendocrine gastroenteropancreatic tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2010, 21 Suppl 5: v223-7. |
| [6] | Li ZS, Li Q. The latest 2010 WHO classification of tumors of digestive system[J]. Zhonghua Bing Li Xue Za Zhi, 2011, 40(5): 351-4. [李增山, 李清. 2010年版消化系统肿瘤WHO分类解读 |
| [7] | Shia J, Tang LH, Weiser MR, et al. Is nonsmall cell type highgrade neuroendocrine carcinoma of the tubular gastrointestinal tract a distinct disease entity? [J]. Am J Surg Pathol,2008, 32(5):719-31. |
| [8] | Chinese pathologic consensus for standard diagnosis of gastrointestinal and pancreatic neuroendocrine neoplasm[J]. Zhonghua Bing Li Xue Za Zhi, 2011,40(4): 257-62. [ 中国胃肠胰 神经内分泌肿瘤病理专家组.中国胃肠胰神经内分泌肿瘤病理 学诊断共识[J]. 中华病理学杂志, 2011, 40(4): 257-62.] |
| [9] | Domori K, Nishikura K, Ajioka Y, et al. Mucin phenotype expression of gastric neuroendocrine neoplasms: analysis of histopathology and carcinogenesis[J]. Gastric Cancer, 2014, 17(2): 263-72. |
| [10] | Ye YH, Zhang S, Wang XF, et al. Reassessment of pathological diagnosis in 90 cases of gastrointestinal neuroendocrine neoplasm[J]. Huazhong Ke Ji Da Xue Xue Bao(Yi Xue Ban), 2012, 41(4):440-4. [叶郁红,张声,王行富,等.90例胃肠道神经 内分泌肿瘤病理学重新诊断评估[J].华中科技大学学报(医学 版),2012,41(4):440-4.] |
| [11] | Ishida M, Sekine S, Fukagawa T, et al. Neuroendocrine carcinoma of the stomach: morphologic and immunohistochemical characteristics and prognosis[J]. Am J Surg Pathol, 2013, 37(7): 949-59. |
| [12] | Capella C, La Rosa S, Uccella S, et al. Mixed endocrine-exocrine tumors of the gastrointestinal tract[J]. Semin Diagn Pathol, 2000, 17(2): 91-103. |
| [13] | Klimstra DS, Modlin IR, Adsay NV, et al. Pathology reporting of neuroendocrine tumors: application of the Delphic consensus process to the development of a minimum pathology data set[J]. Am J Surg Pathol, 2010, 34(3): 300-13. |
| [14] | Klimstra DS, Modlin IR, Coppola D, et al. The pathologic classification of neuroendocrine tumors: a review of nomenclature, grading, and staging systems[J]. Pancreas 2010, 39(6): 707-12. |
| [15] | Zheng J . Standardizat ion in pathologic diagnos i s of gastrointestinal and pancreatic neuroendocrine tumors[J]. Zhonghua Bing Li Xue Za Zhi,2010, 39(12):793-5. [郑杰. 规范胃 肠道和胰腺神经内分泌肿瘤的病理诊断[J]. 中华病理学杂志, 2010, 39(12):793-5.] |
| [16] | Kaltsas GA, Besser GM, Grossman AB. The diagnosis and medical management of advanced neuroendocrine tumors[J]. Endocr Rev, 2004, 25(3): 458-511. |
| [17] | Garcia-Carbonero R, Capdevila J, Crespo-Herrero G, et al. Incidence, patterns of care and prognostic factors for outcome of gastroenteropancreatic neuroendocrine tumors (GEP-NETs): results from the National Cancer Registry of Spain (RGETNE)[J]. Ann Oncol, 2010, 21(9): 1794-803. |
| [18] | Huang ZG, Xie ZM. Clinicopathological study of neuroendocrine neoplasms of gastrointestinal tracts[J]. Xian Dai Yu Fang Yi Xue, 2012, 39(19): 5173-5. [黄治国, 谢宗庙. 胃肠道神经内分泌肿瘤 32 例临床及病理分析[J]. 现代预防医学, 2012, 39(19): 5173-5.] |
 2014, Vol. 41
2014, Vol. 41
