文章信息
- 赵瑞华,李向柯,张伟杰. 2014.
- ZHAO Ruihua, LI Xiangke, ZHANG Weijie. 2014.
- 血浆miR-221的表达与乳腺癌患者新辅助化疗疗效的相关性
- Plasma miR-221 Expression could Predict Chemosensitivity to Neoadjuvant Chemotherapy in Breast Cancer Patients
- 肿瘤防治研究, 2014, 41(10): 1087-1092
- Cancer Research on Prevention and Treatment, 2014, 41(10): 1087-1092
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.10.007
-
文章历史
- 收稿日期:2013-08-23
- 修回日期:2014-01-10
新辅助化疗(neoadjuvant chemotherapy, NAC)在乳腺癌的综合治疗中发挥越来越多的作 用。虽然与传统的辅助化疗相比NAC不能改变乳 腺癌患者的总生存期(overall survival,OS)和无 疾病进展生存期(progression free survival,PFS), 但研究已证实NAC可增加乳腺癌患者的保乳手术 (breast conserving surgery,BCS)率[1]。获得病理 完全缓解(pCR)是接受NAC治疗的患者长期预 后良好的有力指标[2,3,4]。研究发现不同亚型乳腺癌 的pCR率有很大差异,其中基底细胞类型(Basallike) 和HER2阳性表达的乳腺癌患者比腔细胞 样型(Luminal-like)和正常细胞样型(Normallike) 的患者对以紫杉类和蒽环类为主的化疗方 案更敏感[5,6]。目前,尽管一些临床病理及分子指 标如激素受体(hormone receptor,HR)状态、 HER2的表达、肿瘤大小、淋巴结分期、组织学分 级和核分级以及应用基因芯片所做的基因分型可 以初步预测乳腺癌患者对NAC的反应[7,8,9],但目前 我们仍未能有效预测哪些患者将从NAC中受益, 特别是易发生耐药的HR阳性患者[10]。
miRNAs是一类长约22 bp的单链小分子非编码 RNA,大量证据表明,miRNAs在人类肿瘤中多异常 表达,不同miRNAs表达谱与不同来源的人类肿瘤以 及同一肿瘤的不同表型和生物学特性相关[10,11]。最近 的一些研究发现,人类血清和血浆中存在着一些异 常表达的miRNAs,或许可以成为肿瘤及其他疾病诊 断及治疗的一种新的无创性监测手段[12,13,14]。
miR-221定位于X染色体上,通过靶向p27Kip1影 响癌细胞的增殖潜力[15]。在乳腺癌中,miR-221可 以特异性靶向雌激素受体α(ERα)的3’-UTR,其 表达升高导致乳腺癌细胞对他莫昔芬的耐药[16]。 另外,与MCF-7细胞相比,miR-221在阿霉素耐药 株MCF-7/ADR细胞表达显著升高[17]。为了探讨血 浆中miR-221的表达是否可以作为接受NAC治疗 的乳腺癌患者对紫杉类和蒽环类药物治疗反应性 的预测指标,本研究采用从血浆中直接反转录和 PCR扩增的方法测定在中山大学孙逸仙纪念医院 乳腺肿瘤医学部接受NAC治疗的93例乳腺癌患者 和32名健康志愿者血浆中miR-221的表达,比较乳 腺癌患者与健康志愿者中miR-221的表达水平,同 时分析miR-221的表达与乳腺癌患者临床病理特征 和预后的关系。 1 资料与方法 1.1 资料 1.1.1 乳腺癌血标本
93例全血标本取自于2008年 10月—2010年4月在中山大学孙逸仙纪念医院乳腺 肿瘤医学部经粗针穿刺活检后确诊的Ⅰ~Ⅲ期非 转移性乳腺癌并拟接受以紫杉类和蒽环类为基础 的NAC治疗的乳腺癌患者。本项目通过中山大学 孙逸仙纪念医院医学研究伦理委员会的批准和许 可,所有研究对象均签署了在本研究中使用她们 血液样本的知情同意书。 1.1.2 健康志愿者
来源于同时期在中山大学孙 逸仙纪念医院乳腺肿瘤医学部接受乳腺普查并签 署了在本研究中使用她们血液样本知情同意书的 健康妇女。 1.2 方法 1.2.1 患者的治疗和评估
所有患者均接受了以 表柔比星(90 mg/m2)和多西紫杉醇(75 mg/m2) 或紫杉醇(150 mg/m2)为基础的每21 d为一周期 的NAC治疗,至少4个疗程;所有HER2阳性患者 均未在NAC治疗过程中接受赫赛汀治疗;所有患 者在化疗疗程结束后14~28 d接受手术治疗,并在 NAC治疗前后行超声检查其原发肿瘤的大小和腋 窝淋巴结情况;在接受NAC治疗前对所有患者的 原发肿瘤进行粗针穿刺活检,如果伴随临床可触 及的腋窝淋巴结肿大则同时行腋窝淋巴结穿刺活 检。应用RESCIST标准评估患者对治疗的反应: 完全缓解(CR:所有目标病灶完全消失)、部分 缓解(PR:基线病灶长径总和缩小≥30%)、疾 病稳定(SD:基线病灶长径总和缩小但未达PR或 增加未达PD)和疾病进展(PD:基线病灶长径 总和增加≥20%或出现新的病灶)。将pCR定义 为病理检测判定为治疗后原发部位无浸润性癌残 留。其中pCR和PR的患者被认为是NAC治疗有效 (overall response rate,ORR),而PD和SD的患者 视为对化疗耐药[18]。
中山大学孙逸仙纪念医院病理科对治疗前原 发灶标本常规行免疫组织化学(IHC)检测ER、 PR、Ki-67以及拓扑异构酶Ⅱ(Topo Ⅱ)蛋白表达 情况,采用荧光原位杂交法(FISH)或IHC检测 HER2的表达。ER和PR阳性定义为≥10%肿瘤细 胞核内染色;HER2阳性标准为IHC(+++)或FISH阳 性;≥30%肿瘤细胞核染色被认为是Ki-67阳性, TopoⅡ阳性标准为≥10%肿瘤细胞核内染色;采 用Elston-Ellis核分级法对肿瘤进行核分级评估[19]。 1.2.2 血标本的收集和制备
采集接受NAC治疗 前的患者以及健康志愿者的外周血5 ml,放置于含 肝素的抗凝管中。在采集后2 h内2 000 r/min离心 15 min分离成血浆和细胞成分,血浆储存在-80℃ 冰箱备用。 1.2.3 qRT-PCR检测
应用PrimeScript™反转录试 剂盒(Takara Bio Inc,Kyoto,Japan)直接对血浆标 本进行反转录合成cDNA。其中RT混合反应液如 下:5×PrimeScript缓冲液 4 μl;PrimeScript反转录 混合酶Ⅰ 1 μl;miR-221反转录引物(62.5 nmol) 2 μl;血浆 1 μl;DEPC水至总体积20 μl。miR-221 引物为: 5′-GTC GTA TCC AGT GCA GGG TCC GAG GTA TTC GCA CTG GAT ACG ACG AAA CC-3′。在PCR扩增仪进行RT反应,反应条件如 下:42℃ 15 min;85℃ 15 s;反应结束后,将合 成的cDNA样品用蒸馏水稀释至400 μl置于冰上待 用或-20℃保存,然后进行Real-time PCR反应。应 用Hairpin-it miRNAs荧光定量PCR试剂盒 (吉玛,中 国上海) 和罗氏LightCycler 480检测系统。20 μl体 系配制如下:miR-221正向和反向引物(5 μM)各 1 μl;cDNA产物 2 μl;Taq DNA聚合酶(5 u/μl) 0.2 μl;2×Real-time PCR缓冲液 10 μl;dNTP(2.5 mM)1 μl;加水至总体积为20 μl。miR-221的引 物为5′-CCG CAG CTA CAT CTG GCT ACT G-3′ 和 5′-GTG CAG GGT CCG AGG T-3′ [20]。进行PCR反 应,扩增45个循环,每个循环包括95℃ 30 s和60℃ 1 min。设定统一的Ct阈值分析实验结果,取3次实 验的平均值。由于血浆中缺乏有效的对照,我们采 用健康者中位Ct值作为标准对照,患者和健康志愿 者血浆miR-221相对表达水平采用公式2-ΔCt计算, 其中ΔCt= Ct患者或健康志愿者- Ct对照 [12],分别计算乳腺癌 患者和健康志愿者血浆miR-221的表达。 1.3 统计学方法
采用卡方检验比较患者和健康志愿者miR-221 表达水平及与临床病理特征的关系。采用单因素 方差分析和多因素方差分析检测包括血浆miR-221 水平在内的多种临床病理特征对ORR的影响。P值 为双向性检验,检验水准为α=0.05,所有数据采 用SPSS16.0和GraphPad Prism 5.01软件进行分析。 2 结果 2.1 乳腺癌患者的临床特征
本研究中93例患者的临床特征见表 1。所有 患者均接受了以蒽环类和紫杉类为基础的NAC治 疗。诊断时患者的中位年龄为47岁(25~73岁)。 多数患者为浸润性导管癌。一半以上的患者为T2 期同时伴有腋窝淋巴结阳性。大约1/5的患者伴有 脉管浸润,绝大多数患者HR阳性。治疗后大约 15%的患者达到pCR,整体有效率(ORR=pPR+ pCR)为84.94%。
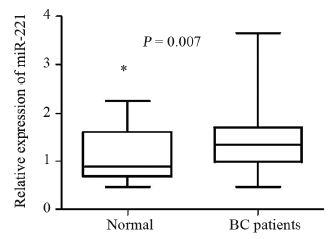
比较乳腺癌患者和健康志愿者血浆miR-221的 表达水平,结果表明乳腺癌患者组血浆miR-221的平 均表达水平明显高于健康志愿者组[分别为(1.453± 0.065)、(1.114±0.093),P=0.007],见图 1。
|
| 图 1 乳腺癌患者中血浆miR-221的表达 Figure 1 Plasma miR-221 expression levels in breast cancer (BC) patients |
根据患者中位表达水平分为miR-221高表达组 和低表达组。血浆miR-221表达水平与患者临床病 理特征的关系,见表 2。结果显示血浆miR-221的 表达仅与患者HR状态显著相关(P=0.008),而 与其他临床病理特征如患者年龄、淋巴结状态、 HER2状态、Ki-67水平、TopoⅡ水平、病理类 型、组织学分级、肿瘤大小、脉管浸润等无关。 高miR-221表达组的患者倾向于HR表达阴性。
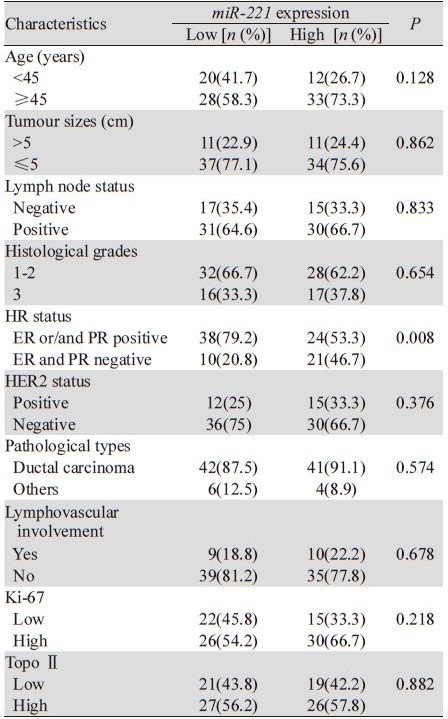 |
| Notes: Low: group with lower miR-221 expression than the median level;High:group with miR-221 expression equal to or higher than the median level |
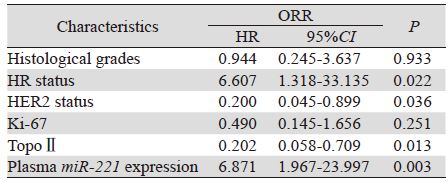
对miR-221高表达组和低表达组进行比较时发 现两组中ORR差异有统计学意义(P=0.044),但 pCR率差异无统计学意义,见表 3。进一步采用单 因素方差分析的方法来分析临床病理因素、血浆 miR-221表达水平与ORR的相关性,发现与ORR相 关的因素包括病理分级、HR状态、HER2表达、 Ki-67的表达、TopoⅡ水平和血浆miR-221的表达高 低,见表 4。多因素分析结果显示HR状态、HER2 表达、TopoⅡ水平和血浆miR-221的表达高低均为 独立的化疗反应预测因素。HR阳性、血浆miR-221 高表达、HER2阴性、TopoⅡ低表达的患者更易对 NAC治疗耐药,而Ki-67表达水平则未能作为独立 的NAC耐药预测指标,见表 5。
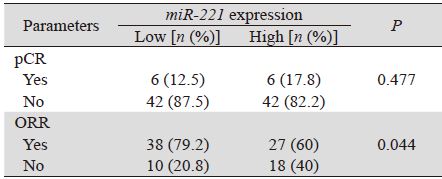 |
| Notes: ORR: overall response rate; ORR=pPR+pCR |
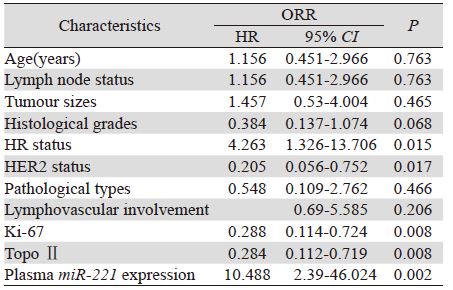 |
| Notes: HR: hazard ratio; CI: confidence interval |
 |
NAC在乳腺癌中的有效性已经在既往研究中得到证实[2]。目前NAC已经广泛地用于对局部晚期 或早期乳腺癌患者的治疗。然而,乳腺癌是一种 异质性疾病,不同患者对治疗的反应存在显著差 异。一些患者在NAC治疗后可以达到pCR,然而 有些患者却表现出对化疗明显耐药。因此,为了 明确哪些患者可以从NAC中获益而哪些患者可以 避免不必要的NAC治疗从而制定有效合理的个体 化治疗方案,在治疗前预测每一位患者对NAC治 疗的反应性非常重要。
本研究采用Pu等[20]之前报道的方法直接从乳 腺癌患者和健康志愿者血浆样品中反转录并进行PCR扩增检测miR-221的表达,结果证实应用该方 法可以高效快速地检测乳腺癌患者和健康志愿者 血浆中miR-221的表达。
miR-221作为一种癌基因在多种肿瘤如结直 肠癌和甲状腺乳头状癌中的表达明显增加[20,21]。 同样,本研究通过比较乳腺癌患者和健康志愿 者之间miR-221的表达水平,表明乳腺癌患者 血浆miR-221的表达水平显著高于健康志愿者 (P=0.007)。尽管只有少量接受NAC治疗的患者 (93例)和健康志愿者(32例)被纳入本研究, 但数据亦表明在乳腺癌中miR-221是一种癌基因。 本研究通过分析血浆中miR-221的表达水平与乳腺 癌患者临床病理特征之间的关系,发现miR-221表 达水平与原发灶HR状况呈负相关(P=0.008), 与下列研究结果一致。有研究发现miR-221在ER阴 性乳腺癌细胞株和原发肿瘤标本中高表达,提示 miR-221可能参与了ERα蛋白的负调控[22]。还有研 究证实ERα可以抑制miR-221和miR-222的表达,因 此miR-221和ER之间或许存在一个负反馈环,可以 促使乳腺癌细胞从ER阳性向阴性的转化,从而有 利于增强乳腺癌细胞的增殖和迁移能力[23]。尽管 有一些研究证实miR-221能够通过调控其靶基因如 p27Kip1的表达而促进肿瘤的生长、维持细胞的增 殖[20,21],但本研究中并没有观察到血浆miR-221表 达水平与其他临床病理因素如Ki-67的表达、肿瘤 大小、淋巴结状态之间的关系,因此本研究仍未 能明确miR-221表达水平与乳腺癌增殖和转移能力 之间的关系。
本研究结果发现,血浆miR-221的表达水平与 ORR有关,但与pCR无关,因此miR-221表达增高 可以作为预测乳腺癌患者对NAC治疗耐药的一项 预测指标。虽然miR-221的表达水平与HR的表达呈 负相关,但本研究应用单因素和多因素Cox回归分 析的方法证实血浆中miR-221的表达水平是不依赖 HR状态的一个独立的预测化疗耐药的因子。在前 期研究中发现与亲本MCF-7细胞株相比miR-221在 阿霉素耐药株MCF-7/ADR中表达显著升高[18],结 合目前研究结果,提示miR-221可能是紫杉类和蒽 环类耐药的有效预测指标。此外,在Rao等[24]研究 中发现miR-221/222过度表达通过调节多种信号通 路导致乳腺癌对氟维司群耐药。综合这些数据, 推测miR-221可以作为一个有希望的治疗靶点来治 疗对选择性雌激素受体调节剂或化疗耐药的乳腺 癌患者。
与其他研究结果一致的是,多因素回归分析中同样发现其他因素如HR状况、HER2状态和TopoⅡ 的表达水平等都是对NAC治疗耐药的独立预测因 素[25,26,27,28]。尽管其他研究结果表明Ki-67同样作为一个 有效的预测NAC反应的指标,但本研究中未能证实 Ki-67为独立的NAC耐药的预测指标[29,30],这种差 异可能是由于对Ki-67表达水平的界定以及本研究 中样本量较小有关。
本研究尚存在一定的局限性。首先,由于种 种原因限制,纳入的乳腺癌患者和健康志愿者的 样本量较小,需要扩大样本量进一步验证。其 次,该研究仅是一项单中心的回顾性研究。第 三,由于血浆中缺乏明确的对照,本研究只能根 据健康志愿者的中位表达水平计算患者和健康志 愿者血浆miR-221的相对表达水平,并且未能建立 一个确切的界值,因此,在进一步的研究中需要 确定一个敏感度和特异性较高的miR-221值,从而 才有可能真正进入到临床应用。
本研究表明,与健康志愿者相比乳腺癌患者 血浆中miR-221的表达增加,同时miR-221的表达 水平与乳腺癌患者HR的表达呈负相关,miR-221 表达增高的患者易出现对紫杉类和蒽环类为主 的NAC治疗耐药。基于本研究结果,认为血浆 miR-221表达水平可能作为一个预测乳腺癌对NAC 治疗反应的指标。然而,仍需要更多研究来进一 步证实miR-221在接受NAC治疗前的应用价值。
(致谢:该研究所需标本及病例资料来源于 中山大学孙逸仙纪念医院乳腺肿瘤中心,在此表 示感谢。)
| [1] | Fisher B, Brown A, Mamounas E, et al. Effect of preoperative chemotherapy on local-regional disease in women with operable breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-18[J]. J Clin Oncol, 1997,15(7):2483-93. |
| [2] | Wolmark N, Wang J, Mamounas E,et al. Preoperative chemotherapy in patients with operable breast cancer: nine-year results from National Surgical Adjuvant Breast and Bowel Project B-18[J]. J Natl Cancer Inst Monogr, 2001,(30):96-102. |
| [3] | Kuerer HM, Newman LA, Smith TL, et al. Clinical course of breast cancer patients with complete pathologic primary tumor and axillary lymph node response to doxorubicin-based neoadjuvant chemotherapy[J]. J Clin Oncol, 1999,17(2):460-9. |
| [4] | Pierga JY, Mouret E, Diéras V, et al. Prognostic value of persistent node involvement after neoadjuvant chemotherapy in patients with operable breast cancer[J]. Br J Cancer, 2000,83(11):1480-7. |
| [5] | Colleoni M, Bagnardi V, Rotmensz N, et al. Increasing steroid hormone receptors expression defines breast cancer subtypes non responsive to preoperative chemotherapy[J]. Breast Cancer Res Treat, 2009,116(2):359-69. |
| [6] | Rouzier R, Perou CM, Symmans WF, et al. Breast cancer molecular subtypes respond differently to preoperative chemotherapy[J]. Clin Cancer Res, 2005,11(16):5678-85. |
| [7] | Precht LM, Lowe KA, Atwood M, et al. Neoadjuvant chemotherapy of breast cancer: tumor markers as predictors of pathologic response, recurrence, and survival[J]. Breast J, 2010,16(4):362-8. |
| [8] | Katz A, Saad ED, Porter P, et al. Primary systemic chemotherapy of invasive lobular carcinoma of the breast[J]. Lancet Oncol, 2007,8(1):55-62. |
| [9] | Bonnefoi H, Potti A, Delorenzi M, et al. Validation of gene signatures that predict the response of breast cancer to neoadjuvant chemotherapy: a substudy of the EORTC 10994/BIG 00-01 clinical trial[J]. Lancet Oncol, 2007,8(12):1071-8. |
| [10] | Fisher ER, Wang J, Bryant J, et al. Pathobiology of preoperative chemotherapy: findings from the National Surgical Adjuvant Breast and Bowel (NSABP) protocol B-18[J]. Cancer, 2002,95(4):681-95. |
| [11] | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004,116(2):281-97. |
| [12] | Chen X, Ba Y, Ma L, et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases[J]. Cell Res, 2008,18(10):997-1006. |
| [13] | Mouillet JF, Chu T, Hubel CA, et al. The levels of hypoxiaregulated microRNAs in plasma of pregnant women with fetal growth restriction[J]. Placenta,2010,31(9):781-4. |
| [14] | Cortez MA, Calin GA. MicroRNA identification in plasma and serum: a new tool to diagnose and monitor diseases[J]. Expert Opin Biol Ther, 2009,9(6):703-11. |
| [15] | Galardi S, Mercatelli N, Giorda E, et al. miR-221 and miR-222 expression affects the proliferation potential of human prostate carcinoma cell lines by targeting p27kip1[J]. J Biol Chem, 2007,282(32):23716-24. |
| [16] | Zhao JJ, Lin J, Yang H, et al. microRNA-221/222 negatively regulates estrogen receptor alpha and is associated with tamoxifen resistance in breast cancer[J]. J Biol Chem, 2008,283(45):31079-86. |
| [17] | Cui XY, Guo YJ, Yao HR. Analysis of microRNA in drug-resistant breast cancer cell line MCF-7/ADR[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2008,28(10):1813-5.[崔秀英,郭运杰,姚和瑞. 耐药 乳腺癌细胞株MCF-7/ADR中microRNA的分析[J]. 南方医科大 学学报, 2008,28(10):1813-5] |
| [18] | Therasse P, Arbuck SG, Eisenhauer EA, et al. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada[J]. J Natl Cancer Inst, 2000,92(3):205-16. |
| [19] | Elston CW, Ellis IO. Pathological prognostic factors in breast cancer.Ⅰ. The value of histological grade in breast cancer: experience from a large study with long-term follow-up[J]. Histop athology,1991,19(5):403-10. |
| [20] | Pu XX, Huang GL, Guo HQ, et al. Circulating miR-221 directly amplified from plasma is a potential diagnostic and prognostic marker of colorectal cancer and is correlated with p53 expression[J]. J Gastroenterol Hepatol,2010,25(10):1674-80. |
| [21] | He H, Jazdzewski K, Li W,et al. The role of microRNA genes in papillary thyroid carcinoma[J]. Proc Natl Acad Sci U S A, 2005,102(52):19075-80. |
| [22] | Zhao JJ, Lin J, Yang H, et al. microRNA-221/222 negatively regulates estrogen receptor alpha and is associated with tamoxifen resistance in breast cancer[J]. J Biol Chem, 2008,283(45):31079-86. |
| [23] | Di Leva G, Gasparini P, Piovan C, et al. microRNA cluster 221-222 and estrogen receptor alpha interactions in breast cancer[J]. J Natl Cancer Inst,2010,102(10):706-21. |
| [24] | Rao X, Di Leva G, Li M,et al. MicroRNA-221/222 confers breast cancer fulvestrant resistance by regulating multiple signaling pathways[J]. Oncogene, 2011,30(9):1082-97. |
| [25] | Ach RA, Wang H, Curry B. Measuring microRNAs: comparisons of microarray and quantitative PCR measurements, and of different total RNA prep methods[J]. BMC Biotechnol,2008,8:69. |
| [26] | Bhargava R, Beriwal S, Dabbs DJ,et al. Immunohistochemical surrogate markers of breast cancer molecular classes predicts response to neoadjuvant chemotherapy: a single institutional experience with 359 cases[J]. Cancer,2010,116(6):1431-9. |
| [27] | Zhu L, Li YF, Chen WG,et al. HER2 and topoisomerase Ⅱalpha: possible predictors of response to neoadjuvant chemotherapy for breast cancer patients[J]. Chin Med J (Engl), 2008,121(20):1965-8. |
| [28] | Konecny GE, Pauletti G, Untch M,et al. Association between HER2, TOP2A, and response to anthracycline-based preoperative chemotherapy in high-risk primary breast cancer[J]. Breast Cancer Res Treat,2010,120(2):481-9. |
| [29] | Nishimura R, Osako T, Okumura Y,et al. Clinical significance of Ki-67 in neoadjuvant chemotherapy for primary breast cancer as a predictor for chemosensitivity and for prognosis[J]. Breast Cancer, 2010,17(4):269-75. |
| [30] | von Minckwitz G, Sinn HP, Raab G, et al. Clinical response after two cycles compared to HER2, Ki-67, p53, and bcl-2 in independently predicting a pathological complete response after preoperative chemotherapy in patients with operable carcinoma of the breast[J]. Breast Cancer Res,2008,10(2):R30. |
 2014, Vol. 41
2014, Vol. 41