文章信息
- 崔同建,华杭菊,张桂枫,陈峥,戴永美,陈静波,郑建萍. 2014.
- CUI Tongjian, HUA Hangju, ZHANG Guifeng, CHEN Zheng, DAI Yongmei, CHEN Jingbo, ZHENG Jianping. 2014.
- 膈下逐瘀汤逆转裸鼠移植瘤MDR-1表达的实验
- Experiment of Diaphragmatic Stasis Expelling Decoction Reversing MDR-1 Expression
- 肿瘤防治研究, 2014, 41(10): 1074-1077
- Cancer Research on Prevention and Treatment, 2014, 41(10): 1074-1077
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.10.004
-
文章历史
- 收稿日期:2013-10-25
- 修回日期:2014-03-03
2.福建省人民医院脑病肿 瘤内科
2.Department of Oncology Medicine, People’s Hospital of Fujian
大肠癌是我国常见的消化系统恶性肿瘤,其 发病率近年来呈逐年上升趋势,在我国已居恶性 肿瘤发病率的第3位[1]。大肠癌治疗早期以手术治 疗为主,但对于晚期及术后复发转移的患者化疗 仍为主要治疗方法[2]。以5-Fu为基础的FOLFOX、 FOLFIRI方案为晚期大肠癌常用国际标准化疗方 案,但是肿瘤细胞对这些高选择、多靶点的化疗药 存在多药耐药性,肿瘤细胞的多药耐药是化疗失败 的主要原因。因此寻找高效低毒的多药耐药逆转剂 是当前肿瘤化疗亟待解决的难题。膈下逐瘀汤出自 清代王清任《医林改错》,具有活血化瘀,行气止 痛之功。现代研究表明,膈下逐瘀汤能够抑制肿瘤 细胞增殖、促进肿瘤细胞凋亡、提高抑瘤率、提高 肿瘤晚期患者生活质量的作用[3, 4, 5]。本实验通过建 立耐药性稳定的HCT-8/5-Fu裸鼠移植瘤模型,观察 膈下逐瘀汤对耐药移植瘤MDR-1 mRNA的表达, 为膈下逐瘀汤逆转恶性肿瘤耐药,提高化疗效果提 供客观依据。 1 材料与方法 1.1 细胞培养
人结肠腺癌细胞HCT-8/5-Fu、HCT-8细胞购买 于南京凯基生物科技发展有限公司。 1.2 实验动物
BALB/C-nu/nu裸小鼠(4~6周),雄性,体质 量17~21 g,共28只,购于上海斯莱克实验动物有限 公司,合格证号:SCXK(沪)2012-0002。饲养于福 建中医药大学实验动物中心屏障环境,饲料、饮水 机垫料、笼具均经高压蒸汽灭菌后使用。 1.3 实验药物
膈下逐瘀汤主方组成为:五灵脂、当归、牡 丹皮、赤芍、乌药、延胡索、甘草、香附、红 花、枳壳、川芎、桃仁等纯中药材,购于福建 省立医院,按照常规煎药方法水煎两次,合并 两次水煎药,浓缩至1 g/ml中药浓缩液。氟尿 嘧啶(5-Fu)、长春新碱(VCR)、依托泊苷 (VP-16)、顺铂(DDP)均购于福建省立医院。 1.4 实验试剂
RPMI 1640培养液、胰蛋白酶、胎牛血清、 MTT液购于美国Gibco公司。RT-PCR试剂盒购 于日本TaKaRa公司。MDR-1、β-actin引物由 GenBank数据库中获得基因序列:MDR1基因引 物序列为(扩增产物大小为:144 bp):上游引 物 5'-TCGCTGCTATTATCCATGGAACATT-3’, 下游引物5'-TGCTGATGATCAGAGTACTGTTGGG- 3 ’ ,内参照β - a c t i n 引物序列为( 扩增 产物大小为:157 bp):上游引物5' -GAGAGGGAAAATCGTGCGTGACA- 3’,下游引物 5'-ACCCAAGAAGGAAGGCTGGAAAC-3’。 1.5 实验方法 1.5.1 细胞培养
将人结肠腺癌耐药细胞HCT-8/5-Fu、敏感细 胞HCT-8用RPMI 1640培养液(含10%胎牛血清、 100 u/ml青霉素、100 μg/ml的链霉素)常规细胞培 养。耐药培养体系中加入终浓度为2.0 mg/L的5-Fu 以维持耐药细胞的耐药性。皮下接种前2周,耐药 细胞停用5-Fu,进行常规细胞培养。 1.5.2 MTT检测细胞耐药性
取对数生长期贴壁细胞 HCT-8、HCT-8/5-Fu, 0.25%胰酶消化、离心后,经细胞计数板计数后调 至1×105/ml的细胞悬液。接种于96孔培养板中,每 孔加入100 μl上述细胞悬液,孵育24 h后分别加入 5种不同浓度的VCR、5-Fu、DDP、VP-16四组化 疗药,每种化疗药设5个复孔,设不加化疗药物的 实验对照组和不加细胞的空白对照组。再次孵育 24 h,弃上清液,每孔再次加入10 μl 5 mg/ml MTT 液,孵育4 h。弃上清液,每孔加入100 μl DMSO, 均匀振荡10 min。用酶联仪OD570 nm处测各孔的 吸光值。计算抑制率、耐药倍数。SPSS16.0计算 药物半数抑制浓度(IC50),抑制率(%)=(对照组 OD值-实验组OD值)/对照组OD值×100%,耐药 倍数=耐药细胞IC50/敏感细胞IC50。 1.5.3 裸鼠移植瘤模型的建立及给药
将对数生长期HCT-8/5-Fu细胞4×107/ml接种 于28只裸小鼠右腋下,12天后,肿块平均体积为 100 mm3,将上述裸鼠随机分为四组:对照组、 5-Fu组、膈下逐瘀汤组、膈下逐瘀汤+5-Fu组,四 组均每天给药1次,连续给药14天后颈椎脱臼处 死裸鼠,给药剂量及途径,见表 1。接种后第3、 6、9、12天、给药后第3、6、9、12天及处死,当 天用游标卡尺测量每组裸鼠移植瘤长径(a)、短径 (b),计算瘤体体积。肿瘤体积计算:V=a×b2/2。 末次给药24 h后,剥离瘤体组织。称瘤重,计算抑 瘤率。抑瘤率(%)=(对照组平均瘤重-实验组 平均瘤重)/对照组平均瘤重×100%。
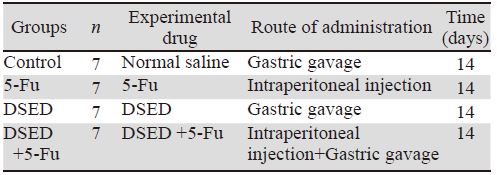 |
| Notes: DSED: diaphragmatic sstasis expelling decoction |
用 Trizol法提取移植瘤总RNA。内参照采用β-actin基 因,引物为根据Gibco公司说明书配置20 μl的反应 体系。采用1 μl进行PCR扩增。扩增条件为95℃预 变性5 min,95℃变性30 s,60℃退火30 s,72℃延 伸30 s,共35个循环,72℃再延伸5 min。扩增产物 大小为144 bp。取PCR扩增产物上样于2%琼脂糖凝 胶电泳(80V,3 min)。凝胶图像系统扫描成像, 扩增条带用Quantity One软件分析,用MDR-1与 β-actin灰度比值表示MDR-1基因表达水平。 1.6 统计学方法
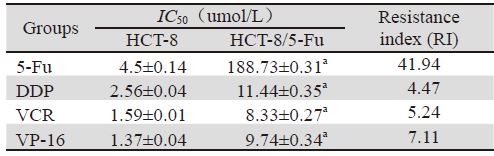
采用SPSS16.0统计软件进行分析,计量资料用 均数±标准差(x±s)表示,组间比较采用单因素方 差分析,P<0.05为差异有统计学意义。 2 结果 2.1 耐药细胞HCT-8/5-Fu多药耐药性的确立
HCT-8/5-Fu细胞株具有多药耐药特性,5-Fu对 耐药细胞的耐药倍数41.94。见表 2。同时该耐药细 胞对结果不同、机制各异的化疗药VCR、DDP和 VP-16均产生不同程度的耐药性。符合肿瘤细胞对 一种化疗药产生耐药性后,对机制不同、结构各 异其他化疗药产生交叉耐药的特性。
 |
裸鼠右腋下接种HCT-8/5-Fu,观察裸鼠接种部 位变化。刚接种时裸鼠接种部位肿胀,第三天可 看到米粒大小的小结节、质硬、可移动,肿块逐 日增大,与周围组织粘连,肿块表面可见丰富的 血管网分布。各组裸鼠肿瘤的生长曲线,见图 1。
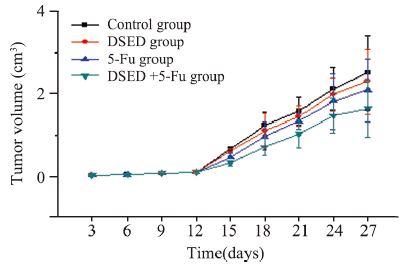
|
| 图 1 裸鼠肿瘤生长曲线 Figure 1 Growth curves of the tumor in nude mice |
给药14天后颈椎脱臼处死裸鼠。剥取瘤组织 称瘤重,见表 3。
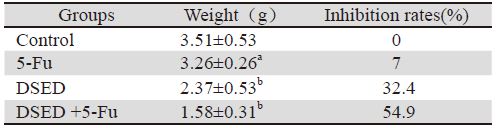 |
| Notes: a: P>0.05, compared with 5-Fu and DSED group; b: P<0.03, compared with control group |
RT-PCR结果显示,与对照组、5-Fu组相比, 膈下逐瘀汤+5-Fu组及膈下逐瘀汤组裸鼠移植瘤中 MDR-1 mRNA表达量均显著降低(P<0.01),5-Fu 组MDR1 mRNA的表达与对照组之间差异无统计 学意义(P> 0.05),见图 2、表 4。
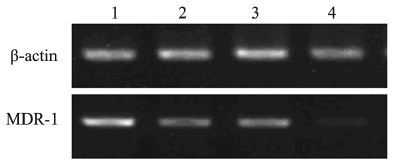
|
| 1: 5-Fu group; 2: DSED group; 3: control group; 4: DSED +5-Fu grouP</span> 图 2 RT-PCR检测瘤组织内MDR-1及β-actin的表达 Figure 2 Expression of MDR1 and β-actin in all groups detected by RT-PCR |
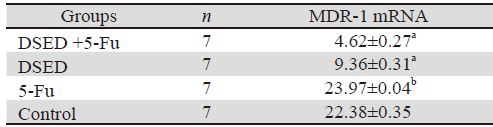 |
| Notes: a: P<0.01, compared with control group; b: P>0.05, compared with control group |
多药耐药是化疗失败的主要原因,肿瘤多药 耐药是指肿瘤细胞对一种抗肿瘤药产生耐药后, 同时对一些未接触过的结构和机制各异的抗肿瘤 药产生交叉耐药现象[6]。目前逆转MDR-1的化学药 物主要为针对MDR-1的编码产物P-gp的逆转剂, 共包括3代,第一代为环孢素、维拉帕米和奎尼丁 等。第二代主要有:右维拉帕米、右尼古地平、 Psc833和Vx710。第三代包括苯甲酰亚胺衍化物和环丙基二苯并环庚烷化物质等,此外还包括免疫逆 转MDR-1、基因技术逆转MDR-1、核酶逆转MDR 等逆转方法。这些逆转剂等因存在心脏毒性、肾脏 毒性、肝毒性、免疫功能抑制等不良反应而限制了 其临床应用[7]。中医药由于不良反应小而受到广大 学者的关注,现代分子生物学研究表明丹皮、姜黄 素、三七、毛冬青等[8-11]对耐药均有不同程度的逆 转作用。针对西药单体靶点单一的特点,我们力图 寻找多靶点、多途径、高效低毒的复方中药逆转化 疗耐药,提高化疗效果。
本实验先用MTT法检测耐5-Fu人结肠腺癌细 胞HCT-8/5-Fu的耐药性,结果显示,本细胞株对 5-Fu具有良好的耐药性,耐药倍数为41.94。通过 对DDP、VP-16、VCR的三种结构及机制不同的化 疗药进行耐药性分析,结果显示耐药细胞对三种 化疗药均产生不同程度的耐药性。符合肿瘤细胞 对一种化疗药产生耐药性后,对机制不同、结构 各异其他化疗药产生交叉耐药的特性[12],明确了 体外诱导人结肠耐药细胞HCT-8/5-Fu耐药性稳定 的特点。通过造模裸鼠耐药人结肠腺癌移植瘤, 药物干预后结果显示:膈下逐瘀汤+5-Fu组肿瘤抑 制率54.9%高于膈下逐瘀汤组及5-Fu组肿瘤抑制 率,差异具有统计学意义。而膈下逐瘀汤+5-Fu组 肿瘤抑制率与膈下逐瘀汤组相比,差异具有统计 学意义(P<0.01)。从而说明膈下逐瘀汤能够提 高化疗有效率,与化疗药合用对大肠癌耐药裸鼠 移植瘤生长具有抑制作用。
RT-PCR检测MDR-1 mRNA表达,结果发现,膈 下逐瘀汤+5-Fu组和膈下逐瘀汤组的逆转和翻译水 平显著下降,初步证实膈下逐瘀汤通过逆转MDR-1 基因的表达,增强肿瘤细胞对药物的敏感度。
综上所述,膈下逐瘀汤对大肠癌多药耐药裸鼠 移植瘤生长具有明显抑制作用,能够减缓肿瘤体 积的增长,抑制肿瘤生长,其机制可能为通过逆转 MDR-1的表达而提高肿瘤细胞对药物敏感度。但同 时,耐药问题与Bcl-2蛋白、肺耐药蛋白、谷胺甘肽 S转移酶(GSTs)、拓扑异构酶II(Topo II)等多种因 素有关,下一步我们将更加完善其他耐药指标的检 测,以进一步明确耐药机制及其发挥祖国医学逆转 恶性肿瘤耐药的临床应用。
| [1] | Wang JH, Li SR. Retrospective analysis of colorectal cancer screening and early diagnosis in China:1994-2005[J].Wei Chang Bing Xue, 2006, 11(4): 245-50.[王继恒, 李世荣. 我国结直肠癌 筛查和早期诊断十年回顾: 1994-2005[J].胃肠病学, 2006, 11(4): 245-50.] |
| [2] | Urruticoechea A, Alemany R, Balart J, et al. Recent advances in cancer therapy: an overview[J].Curr Pharm Des, 2010, 16(1):3-10. |
| [3] | Huang YR,Zhou H,Fei XY, et al. Influence of GXZY decoction on expression and regulation of cancer gene bax,bcl-2,P53of human hepatocarcinom cell[J].Zhong Xi Yi Jie He Gan Bing Za Zhi,2008, 18(6): 355-6,366.[黄廷荣, 周虹, 费新应, 等.膈下逐瘀 汤加减对人肝癌细胞bax、bcl-2、P53基因表达调控的影响[J]. 中西医结合肝病杂志, 2008, 18(6): 355-6, 366.] |
| [4] | Lian YY, Zhao JR, Ren R, et al.Experimental study of decoction for removing blood stasis in diaphragm combined with cyclophosphamide on inducing apoptosis of Hca-f liver cancer mice[J]. Shan Xi Zhong Yi,2010,26(3):50-1,56. [连媛媛, 赵金茹, 任蕊, 等. 膈下逐瘀汤联合环磷酰胺诱导Hca-f肝癌小鼠细胞调 亡的实验研究 [J]. 山西中医, 2010, 26(3): 50-1, 56.] |
| [5] | Zhang BN. Infradiaphragmatic Stasis-Expelling Decoction for survival quality of advanced pancreatic cancer [J].Liaoning Zhong Yi Za Zhi 2008, 35(10): 1518-9. [张宝南. 膈下逐瘀汤对晚期胰 腺癌生存质量的影响[J]. 辽宁中医杂志, 2008, 35(10): 1518-9.] |
| [6] | Kim IJ, Bae YT, Kim SJ, et al. Determination and predicition of P-glycoprotein and mulidrug-resisitance-related protein expression in breast cancer with double-phase technetium- 99m sestamibi scintimammography. Visual and quantitative analyses[J]. Oncology, 2006, 70(6): 403-10. |
| [7] | Liao SL, Wang P. Research progress on multidrug resistance mechanism of cancer cells and its reversal agents[J].Guo Wai Yi Yao Kang Sheng Su Feng Ce, 2008, 29(1):7-11. [廖绍兰, 王平. 肿瘤多药耐药机制就逆转剂的研究进展[J]. 国外医药抗生素分 册, 2008, 29(1): 7-11.] |
| [8] | Sun HJ, Wang XQ, Yu LM, et al. The study of Paeonol for MDR’ s reverse action[J].Jie Pou Ke Xue Jin Zhan, 2000, 6(1):59-62.[孙 慧君, 王晓琦, 于丽敏, 等. 丹皮酚对MDR逆转作用的研究[J]. 解剖科学进展, 2000, 6(1): 59-62.] |
| [9] | Lu WD, Fu ZX, Tan Y, et al. Curcumin reverses multidrug resistance in HCT-8/VCR nude mice xenograft[J].Di San Jun Yi Da Xue Xue Bao,2011,33(4):376-80. [卢伟东, 傅仲学, 覃勇, 等. 姜黄 素逆转结肠癌裸鼠移植瘤多药耐药研究[J]. 第三军医大学学报, 2011, 33(4): 376- 80.] |
| [10] | Shi YQ, Tian TD.Experiment of Panax Notoginseng Saponins reversing multi-resistance of K56/VCR cells in vitro[J]. Zhongguo Zhong Yi Yao Ke Ji, 2005, 12(5):292-4.[史亦谦,田同德.三七总 皂甙体外逆转K56/VCR细胞多药耐药的实验研究[J]. 中国中 医药科技, 2005, 12(5): 292-4.] |
| [11] | Zhao ZY. Influence of Llexonin on the cytotoxic effect of daunorubicin on leukemia cells[J]. Hu,nan Zhong Yi Za Zhi, 2003, 19(5):53.[赵早云.毛冬青甲素影响柔红霉素对白血病细胞的细 胞毒作用研究[J]. 湖南中医杂志, 2003, 19(5): 53.] |
| [12] | Takara K, Sakaeda T, Okumura K.An update on overcoming MDR1-mediated multidrug resistance in cancer chemotherapy[J]. Curr Pharm Des, 2006, 12(3): 273-86. |
 2014, Vol. 41
2014, Vol. 41
