文章信息
- 王飞通,周兵,刘小云,汪正伟,牛坚,魏鑫,刘斌. 2014.
- WANG Feitong, ZHOU Bing, LIU Xiaoyun, WANG Zhengwei, NIU Jian, WEI Xin, LIU Bin. 2014.
- 乳腺癌耐药蛋白ABCG2对胰腺癌SW1990细胞耐药性影响的实验
- Effect of ABCG2 Expression on Chemoresistance of Pancreatic Carcinoma Cell Line SW1990
- 肿瘤防治研究, 2014, 41(10): 1070-1073
- Cancer Research on Prevention and Treatment, 2014, 41 (09): 1070-1073
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.10.003
-
文章历史
- 收稿日期:2014-01-10
- 修回日期:2014-02-12
2. 徐州医学院研究生学院;
3. 徐州医学院附属医院中心实验室
2. Graduate School of Xuzhou Medical College;
3. Central Laboratory, Affiliated Hospital of Xuzhou Medical College
胰腺癌是一种恶性程度极高、治疗效果及预 后极差的肿瘤,在西方国家总体5年生存率不超过 5%[1],且手术切除率仅有10%~15%[2],术后不久 就会出现复发和转移。有研究表明[3],可切除的 胰腺癌的标准治疗应该是手术加术后系统性辅助 化疗。吉西他滨(gemcitabine,GEM)是第一个 能有效缓解胰腺癌症状和改善预后,具有临床疗 效的新型抗癌药物[4],也是经美国食品和药品监 督管理局(FDA)批准的胰腺癌治疗药物,即所 谓的金标准[5]。但吉西他滨单药治疗胰腺癌的中位 生存期仅为5.4~5.6月,一年生存率仅为16%~19%,效 果仍不理想,这与胰腺癌内在的和(或)获得性的耐 药密切相关。乳腺癌耐药蛋白ABCG2(ATP-binding cassette,subfamily G,member 2)是一种跨膜糖蛋 白,为ABC超家族成员之一。国外已有大量文献报道 ABCG2参与多种肿瘤细胞多药耐药机制[6-8],甚至被 作为肿瘤干细胞的标志用来筛选肿瘤干细胞。但国 内对于ABCG2与胰腺癌耐药方面报道较少,本实验 旨在探讨GEM诱导胰腺癌细胞中ABCG2的表达及其 与化疗耐药的关系。 1 材料与方法 1.1 细胞株和主要试剂 1.1.1 细胞株
胰腺癌细胞株SW1990由南京医科大 学第一附属医院胰腺中心苗毅教授馈赠。 1.1.2 试剂
GEM(江苏正大天晴药业股份有限公 司),蛋白抽提试剂盒、BCA蛋白定量试剂盒(北京 碧云天生物技术公司),RT试剂盒(北京天根生化 科技有限公司),兔抗人ABCG2多克隆抗体(美国 Epitomics公司),辣根过氧化物酶标记的山羊抗兔及 山羊抗鼠IgG抗体、鼠抗人β-actin抗体(北京中杉金 桥生物技术有限公司),ABCG2及β-actin引物由上海 生工生物工程股份有限公司合成。 1.2 试验方法 1.2.1 细胞培养与传代
用0.25%的胰酶及0.02% EDTA的消化液消化SW1990细胞,用含10%胎牛血清 的DMEM高糖培养液,在37℃、浓度为5%CO2、饱和 湿度的培养箱中培养,细胞每2~3d按1:3传代1次。 1.2.2 MTT法测定SW1990细胞对GEM的半数有 效浓度(IC50)
(1)取70%~80%融合并处于对数 生长期的细胞,调节细胞浓度为每孔5×103,接种 于含100 μl上述培养液的96孔板中,在37℃、CO2体积 分数为5%,饱和湿度的培养箱中培养24 h。(2)细胞 贴壁后,更换成含有不同浓度GEM的培养液100 μl, 浓度分别为8、2、0.5、0.125、0.03 mg/ml,每个浓度设 6个复孔,以不加药物的细胞存活率为100%的孔和没 有接种细胞的培养液孔分别作为阴性对照组和空白 对照组。(3)细胞在浓度梯度药物作用下分别培养 24、48和72 h,每孔加入20 μl的MTT试剂,继续培养 4 h后,吸弃培养液,每孔加入200μl二甲基亚砜溶液, 室温25℃振荡8 min使结晶充分溶解。(4)在酶联免 疫检测仪450 nm波长处测各孔吸光度(OD)值,参比 波长630 nm。(5)细胞增殖抑制率(%)=(1-试验孔 OD值/对照孔OD值)×100%,根据IC50计算软件分别 得出24、48及72 h细胞对化疗药物的IC50。 1.2.3 GEM对SW1990胰腺癌细胞内ABCG2的诱导
取融合率为70%~80%处于对数生长期的SW1990 细胞进行消化传代至培养瓶,并调整细胞浓度为 每瓶1×106,在37℃、CO2体积分数为5%,饱和湿度 的培养箱中培养24 h。待细胞贴壁后,参考24 h的 IC50,更换成含有0.82 mg/ml GEM的培养液4.5 ml, 继续培养24、48和72 h后作为实验组(分别为B组、 C组及D组),以未加GEM的细胞作为对照组(A组), 检测ABCG2 mRNA及ABCG2蛋白的表达。 1.2.4 流式细胞仪分析细胞凋亡
用不含EDTA的 胰酶消化各组细胞至单细胞悬液状态,1 200 r/min 离心5 min弃上清液后,加入PBS清洗再离心,重 复3次,收集细胞每管1×106,按凋亡试剂盒步骤逐 步进行染色后,在FACS Vantage SE流式细胞仪上 进行检测。 1.2.5 Western blot检测ABCG2蛋白的表达
PMSF 裂解液提取细胞总蛋白,并用BCA蛋白定量试剂盒 定量,取样本蛋白20 μg上样进行10%聚丙烯酰胺凝 胶电泳,调整电泳电压80 V进行30 min,当样本进 入分离胶时,调节电压使其恒定在120 V,维持1 h。 调整恒定电流为50 mA(电流mA=胶长×宽×2.5), 转78 min(时间=分子量+6 min)至PVDF膜上,用含 5%脱脂奶粉的TBST缓冲液封闭2 h。分别加入兔抗 人ABCG2抗体及鼠抗人β-actin抗体于4℃过夜,加入 1:5 000辣根过氧化物酶标记的山羊抗兔及山羊抗鼠 IgG抗体。进行压片显影,且采用Image J软件测量条 带灰度值并进行数据处理,以β-actin蛋白作为内参 照进行目的蛋白定量分析。 1.2.6 RT-PCR检测ABCG2 mRNA的表达
采 用Tr i zol 法提取实验组、对照组的总RNA。取 10 μ g 反转录合成cDNA,ABCG2 上游引物: 5′-AATACATCAGCGGATACTACAGAG-3′,下 游引物:5′-AGCCACCATCATAAGGGTAAACA T-3',扩增长度179 bp;内参照β-actin上游引物: 5′-CGGGAAATCGTGCGTGAC-3′,下游引物:5′- TGGAAGGTGGACAGCGAGG-3′,扩增长度434 bp。 PCR反应条件:95℃ 3 min,95℃ 30 s,57℃ 30 s, 72℃ 1 min(35个循环),72℃ 5 min。各取5 μl PCR反应产物混合10 g/L琼脂糖凝胶电泳,通过 Smart View凝胶成像扫描仪观察。 1.3 统计学方法
采用SPSS 13.0统计软件进行统计学处理,两 样本均数比较采用t检验,多样本均数间比较采用 单因素方差分析,检验水准α=0.05,P<0.05为差 异有统计学意义。 2 结果 2.1 GEM对胰腺癌细胞株SW1990的增殖影响
MTT结果显示,在同一浓度时,随着作用时 间的延长,GEM对细胞株的抑制逐渐减低,且两 两比较差异有统计学意义(P<0.05),在同一时间 点时,随着药物浓度的增加,GEM对细胞株的抑 制效应逐渐增强,且两两比较差异有统计学意义 (P<0.05)。24 h、48 h及72 h GEM对SW1990细胞 的IC50分别为(0.82±0.08) mg/ml、(1.58±0.16) mg/ml和(2.36±0.15)mg/ml,随着时间延长,IC50逐 渐增加(P<0.05)。可以得出,GEM对胰腺癌细胞 株SW1990有明显的时间和浓度依赖性,见表 1。
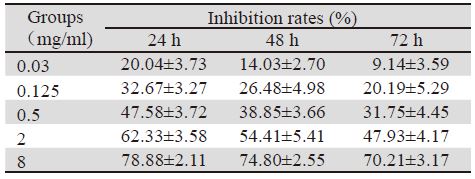 |
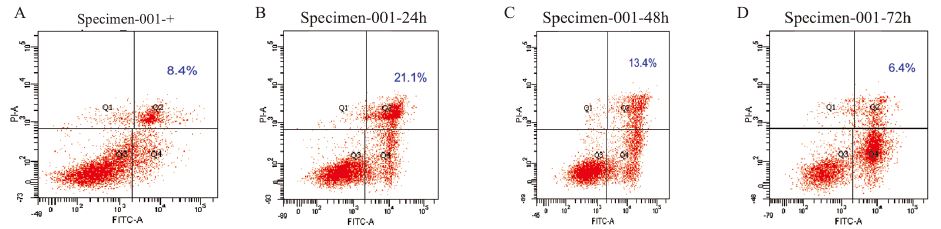
流式细胞仪分析显示,0.82 mg/ml GEM作用 胰腺癌SW1990细胞株不同时间后,与对照组相比 较,细胞晚期凋亡率逐渐减低,且两两比较差异有 统计学意义(P<0.05),见图 1。
|
| A:control group; B: 24h; C: 48h; D:72h 图 1 0.82mg/ml GEM作用胰腺癌SW1990细胞株不同时间点后细胞凋亡分析 Figure 1 Apoptosis of pancreatic cancer cell line SW1990 treated with 0.82mg/ml GEM at different time points |
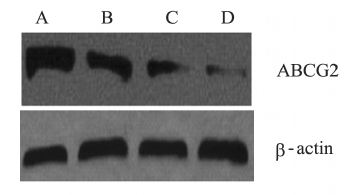
以β-actin的灰度为内参照,比较β-actin与目的 蛋白ABCG2条带灰度比值。加药后24、48及72 h组 与对照组比较,分别上升(2.17±0.14)倍、(3.61 ±0.09)倍和(4.98±0.13)倍,且加药后24 h与48 h 组、24 h与72 h组、48 h与72 h组两两比较差异均具 有统计学意义(P<0.05)。提示ABCG2蛋白的表 达具有明显的时间依赖性,见图 2。
|
| A:72h;B: 48h; C: 24h; D:control group 图 2 0.82mg/ml GEM作用不同时间点后胰腺癌SW1990细 胞株中ABCG2 蛋白的表达 Figure 2 ABCG2 protein expression in pancreatic cancer cell line SW1990 treated with 0.82mg/ml GEM at different time points |
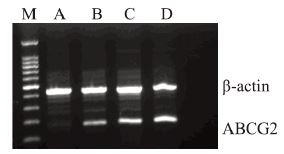
以β-actin的灰度为内参照,比较β-actin与目的 基因ABCG2条带灰度比值。加药后24、48及72 h组 与对照组比较,分别上升(2.21±0.11)倍、(3.30 ±0.08)倍和(4.72±0.12)倍,且加药后24 h与48 h 组、24 h与72 h组、48 h与72 h组,两两比较差异均 具有统计学意义(P<0.05)。提示ABCG2 mRNA 的转录具有明显的时间依赖性,见图 3。
|
| M: marker;A:control group; B: 24h; C: 48h; D:72h 图 3 0.82mg/ml GEM作用不同时间点后胰腺癌SW1990细 胞株中ABCG2 mRNA的转录情况 Figure 3 ABCG2 mRNA transcription in pancreatic cancer cell line SW1990 treated with 0.82mg/ml GEM at different time points |
Doyle在研究维拉帕米筛选的乳腺癌耐阿霉素 株(MCF-7/AdrVP)时发现一段cDNA转染MCF-7细 胞后,细胞株对甲氨蝶呤、阿霉素和柔红霉素产生 了耐药,并降低细胞内柔红霉素的蓄积、滞留,增 加了罗丹明外排,故将其编码的跨膜转运蛋白称 为乳腺癌耐药蛋白(breast cancer resistance protein,BCRP/ABCG2)。ABCG2介导的多药耐药机制目前 尚不完全明确,一般认为有以下两种:(1)加速化 疗药物的外排,降低细胞内有效化疗药物浓度,尤 其在耐药的肿瘤细胞中,ABCG2可高效运载多种化 疗药物[9];(2)影响肿瘤细胞中化疗活性药物的作 用,主要表现在降低药物的活化或增强细胞内药物 的解毒作用,例如甲氨蝶呤,在细胞内通过多聚谷酰 胺化提高活性,作用于靶酶发挥疗效。ABCG2不仅 能转运甲氨蝶呤原型,还能与在细胞内活化的多聚 谷酰胺化形式的甲氨蝶呤高度亲和,与后者结合后 泵出细胞,这种能结合转运药物活化成分的功能是 其他耐药蛋白所不能具备的[10]。
随着研究的进展,ABCG2的高表达常作为肿 瘤不良预后的指标[11-13]。Benderra等[14]研究结果表 明:在急性白血病组中ABCG2基因的阳性表达率 达37.6%;ABCG2 mRNA阴性和阳性患者化疗后的 首次完全缓解率分别为79.3%和31.6%;复发组中 ABCG2 mRNA的水平明显高于新诊断组,而在正常 个体和长期存活的白血病患者中,ABCG2基因的表 达水平非常低,ABCG2 mRNA的高表达直接导致 临床耐药的发生,对急性白血病的预后是一个不良 的标志。Zen等[15]在研究人肝癌标本肿瘤干细胞时 发现,从标本中分离出了少量的侧群细胞,这种侧 群细胞能进行不对称分裂生成,具有无限增殖的能 力,而这种侧群细胞具有高表达耐药蛋白ABCG2的 能力,对细胞毒性药物有很强的抵抗性,对化疗不 敏感。
本研究结果显示,GEM对胰腺癌细胞株有明 显的时间和浓度依赖性。但24、48及72 h GEM对 SW1990细胞的IC50分别为(0.82±0.08)mg/ml、(1.58 ±0.16)mg/ml和(2.36±0.15)mg/ml,这表明随着时 间的延长,SW1990细胞株对吉西他滨的化疗敏感度 逐渐减低,在细胞株中有药物耐药的产生,流式细 胞的结果也得出相似的结论。同时RT-PCR及Western blot结果显示,在使用0.82 mg/ml GEM作用胰腺癌 SW1990细胞株24、48、72 h后,ABCG2 mRNA与蛋 白的表达较未用药组相比逐渐上升,组间比较P值均 小于0.05。说明GEM能诱导ABCG2的增加,呈时间 依赖性,而ABCG2的增加可能促进胰腺癌SW1990 细胞株对GEM的抵抗,使细胞获得化疗耐药,这与 Summer等[16]研究乳腺癌耐药的结果相似。
总之,GEM能诱导胰腺癌细胞内ABCG2表达升 高,而其表达增加可能就是胰腺癌产生化疗耐药的 机制之一,这对后续研究提高胰腺癌细胞对化疗药 物的敏感度,抑制ABCG2的过表达有着重要意义。
| [1] | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62(1):10-29. |
| [2] | Chua YJ, Zalcberg JR. Pancreatic cancer--is the wall crumbling?[J]. Ann Oncol, 2008, 19(7): 1224-30. |
| [3] | Neoptolemos JR, Stocken DD, Friess H, et al. A randomized trial of chemoradiotherapy and chemotherapy after resection of pancreatic cancer[J]. N Engl J Med, 2004, 350(12):1200-10. |
| [4] | Burris HA 3rd, Moore MJ, Andersen J, et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patient with advanced pancreas cancer: a randomized trial[J]. J Clin Oncol, 1997, 15(6): 2403-13. |
| [5] | Rothenberg ML. New developments in chemotherapy for patients with advanced pancreas cancer[J]. Oncology (Williston Park), 1996, 10(9 Suppl): 18-22. |
| [6] | Natarajan K, Xie Y, Baer MR, et al. Role of breast cancer resistance protein(BCRP/ABCG2) in cancer drug resistance[J]. Biochem Pharmacol,2012,83(8): 1084-103. |
| [7] | Mosaffa F, Kalalinia F, Parhiz BH, et al. Tumor necrosis factor alpha induces stronger cytotoxicity in ABCG2-overexpressing resistant breast cancer cells compared with their drug-sensitive parental line[J]. DNA Cell Biol, 2011, 30(6): 413-8. |
| [8] | Peng H, Qi J, Dong Z, et al. Dynamic vs static ABCG2 inhibitors to sensitize drug resistant cancer cells[J]. PLoS One, 2010, 5(12): e15276. |
| [9] | Cusatis G, Sparreboom A. Pharmacogenomic importance of ABCG2[J]. Pharmacogenomics, 2008, 9(8): 1005-9. |
| [10] | Wielinga P,Hooijberg JH,Gunnarsdottir S,et al. The human multidrug resistance protein MRP5 transports folates and can mediate cellular resistance against antifolates[J]. Cancer Bes, 2005, 65(10): 4425-30. |
| [11] | Wang YH, Li F, Luo B, et al. A side population of cells from a human pancreatic carcinoma cell line harbors cancer stem cell characteristics[J]. Neoplasma, 2009, 56(5): 371-8. |
| [12] | Yajima T, Ochiai H, Uchiyama T, et al. Resistance to cytotoxic chemotherapy-induced apoptosis in side population cells of human oral squamous cell line Ho-1-N-1[J]. Int J Oncol, 2009, 35(2): 273-80. |
| [13] | Dou J, Wen P, Hu W, et al. Identifying tumor stem-like cells in mouse melanoma cell lines by analyzing the characteristics of side population of cells[J]. Cell Biol Int, 2009, 33(8): 807-15. |
| [14] | Benderra Z,Faussat AM, Sayada L, et al.Breast cancer resistance protein an P-glycoprotein in 149 adult acute myeloid leukemias[J]. Clin Cancer Res, 2004,10(23):7896-902. |
| [15] | Zen Y,Fujii T,Yoshikawa S,et al.Histological and culture studies with respect to ABCG2 expression support the existence of a cancer cell hierarchy in human hepatocellular carcinoma[J]. Am J Pathol, 2007, 170(5): 1750-62. |
| [16] | Summer R, Kotton DN,SunX,et al. Side population cells and Bcrpl expression in lung[J].Am J Physiol Lung Cell Mol Physiol, 2003, 285(1):L97-104. |
 2014, Vol. 41
2014, Vol. 41


