文章信息
- 黄宇,唐海娟,何志义,张建全,白晶. 2014.
- HUANG Yu, TANG Haijuan, HE Zhiyi, ZHANG Jianquan, BAI Jing. 2014.
- 西仑吉肽对肺腺癌A549细胞裸鼠移植瘤生长抑制作用及其机制
- Inhibition of Cilengitide on Tumor Growth of A Nude Mouse Model with Lung Adenocarcinoma Cell Line A549 and Its Mechanism
- 肿瘤防治研究, 2014, 41(10): 1064-1069
- Cancer Research on Prevention and Treatment, 2014, 41(10): 1064-1069
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.10.002
-
文章历史
- 收稿日期:2013-08-16
- 修回日期:2014-03-13
2. 广西医科大学第一附属医院呼吸内科
2. Department of Respiratory Medicine, First Affiliated Hospital of Guangxi Medical University
非小细胞肺癌(non-small cell lung cancer , NSCLC)为发病率较高的恶性肿瘤,对放化疗敏感 度差,易发生耐药,而且瘤体血管丰富,易早期转 移,现有的治疗效果还不理想。近年来,随着医学 分子生物学理论和技术的发展,针对肺癌发病机制 的靶向分子生物学研究为肺癌治疗开辟了新的途 径。分子靶向治疗肿瘤细胞逆转其耐药、抑制其血 管生成已成为目前抗肿瘤研究的热点。西仑吉肽属 于靶向作用于血管内皮细胞整合素的新型抗血管生 成靶向药物,临床研究结果显示对恶性胶质瘤、脑 和中枢神经系统癌症等具有抗血管生成和生成抑制 双重作用[1],但是对于肺癌的研究较少。本研究应 用西仑吉肽对肺腺癌裸鼠的移植瘤模型进行干预, 观察抑瘤效果,探讨其抑瘤机制, 并比较其与化疗 药物顺铂联合应用的疗效。 1 资料与方法 1.1 材料
BALB/c-nu雄性裸鼠(SPF清洁级) 48只,鼠龄 6~8周,体质量16~24 g,由广西医科大学实验动物 中心提供。瘤株:A549人肺腺癌细胞株(实验室自 备)。Trizol、DNAmarker、PCR反应体系购自日本 TaKaRa公司,骨桥蛋白(osteopontin,OPN)mRNA 、 细胞外调节激酶1(cellular signal-regulated protein kinase 1,ERK1)mRNA、血管内皮生长因子(vascular endothelial growth factor, VEGF)mRNA引物均购 自上海生工生物工程技术服务有限公司,细胞 裂解液、BCA蛋白浓度测定试剂盒、超敏ECL 化学发光试剂盒均购自上海碧云天生物技术有 限公司,成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、血管内皮生长因子受体抑 制剂(SU5416)、表皮生长因子(epidermal growth factor,EGF)、ERK抑制剂(PD98095)购自美国CST 公司,OPN一抗、ERK1一抗、p- ERK1一抗、 VEGF一抗购自美国Santa Cruz公司,辣根酶标记 抗小鼠IgG二抗购自北京中杉金桥生物技术公司。 1.2 裸鼠移植瘤模型制备
A549细胞在37℃、5%饱和湿度CO2培养箱 内,用含10%新生牛血清的RPMI 1640培养液中, 每2~3天换液,定期传代,取指数生长期细胞加入 0.25%胰蛋白酶消化1 min,收集细胞并确定细胞活 力在95%以上,调整细胞终密度为2.5×107 /0.2 ml细 胞悬液备用。
取上述细胞悬液以每只0 .2 ml接种于裸鼠(BALB/c-nu)右下肢外侧皮下,饲养于恒温(26℃ ~28℃)、恒定湿度(40%~60%)的SPF层流实验室 中,用经高压灭菌的饲料和水供动物自由饮食。 接种后每天观察有无肿瘤形成及注射点有无破溃 红肿,隔日用游标尺测量肿瘤大小,肿瘤体积 (mm3)=长径×短径2/2[2]。 1.3 实验动物分组
待皮下肿瘤生长至长径约0.7 cm时,随机将裸 鼠分为6组,每组8只:(1)空白组:每日腹腔内注 射0.9%氯化钠溶液,每次0.2 ml。(2)顺铂组:每隔 3 d腹腔内注射顺铂稀释液[3],每次0.2 ml,注射剂 量为5 mg/kg。(3)小剂量西仑吉肽组:每日腹腔内 注射西仑吉肽稀释液[4],每次0.2 ml,注射剂量为 100 μg/d。(4)大剂量西仑吉肽组:隔日腹腔内注射 西仑吉肽稀释液,每次0.2 ml,注射剂量为200 μg/d。 (5)小剂量西仑吉肽+顺铂组:每日腹腔内注射西仑 吉肽稀释液,每次0.2 ml,注射剂量为100 μg/d, 每隔3d腹腔注射顺铂稀释液,每次0.2 ml。(6)大剂 量西仑吉肽+顺铂组:每日腹腔内注射西仑吉肽稀 释液,每次0.2 ml,注射剂量为200 μg/d,每隔3d 腹腔注射顺铂稀释液,每次0.2 ml。。 1.4 A549细胞培养及分组
A549 细胞用含10%新生牛血清的RPMI 1640 培养液接种于培养瓶或96孔板,应用西仑吉肽、 VEGF受体激动剂bFGF、血管内皮生长因子受体 抑制剂SU5416、ERK1受体激动剂EGF和ERK抑制 剂PD98095干预A549 细胞,观察对细胞ERK1蛋 白磷酸化水平及VEGF蛋白的影响。具体如下:先 用无血清的Dulbeccoco改良的DMEM培养液培养 24 h,使细胞同步于G0期,然后按随机化分配原则 分别分为下列3小组:(1)对照组:不加入任何干预 剂;(2)西仑吉肽组:加入西仑吉肽 4 μg/ml; (3)西 仑吉肽组+bFGF组:加入bFGF10mg/L 1 h后再加入 西仑吉肽 4 μg/ml;(4)SU5416组:加入SU5416 0.4 μmol/L;(5)bFGF+SU5416组: 加入SU5416 0.4 μmol/L 1 h后再加入bFGF 10 mg/L;(6)西仑吉肽组 +EGF组;加入EGF 20 mg/L 1 h后再加入西仑吉肽 4 μg/ml;(7)PD98059组:加入PD98059 10 μmol/L; (8)EGF+PD98059组;加入PD98059 10 μmol/L 1 h 后再加入EGF 20 mg/L,每组设4个复孔。 1.5 观察指标及方法 1.5.1 移植瘤体积及重量
治疗4周后,停药1周,应用水合氯醛处死裸 鼠。剥取肿瘤组织,称重,观察肿瘤转移情况。 肿瘤组织经10%福尔马林固定,石蜡切片和常规 HE染色,按公式计算肿瘤体积。 1.5.2 Western blot检测裸鼠肿瘤中整合素β3、β5蛋白表达
液氮磨组织提取蛋白,首先取100 mg组织加 入0.75 ml细胞裂解液,提取总蛋白。用BCA蛋白 浓度测定试剂盒测定蛋白质浓度以保证每个上样 孔总蛋白量一致。蛋白变性、上样,12% 十二烷 基硫酸钠-聚丙烯酰胺凝胶电泳,随后转膜,孵育一 抗(稀释比例1 :1 000)、二抗(稀释比例1 :2 000), ECL 发光,胶片曝光。以β-actin作为内参照。胶 片扫描并照相,测定各条带灰度值。以目的蛋白 和β-actin条带A值之比作为反映目的蛋白表达水 平,实验重复3次。 1.5.3 RT-PCR检测裸鼠肿瘤中OPN、ERK1、VEGF mRNA表达
液 氮 磨 组 织 提 取R N A,首 先 反 转 录 成 cDNA,随后PCR扩增。OPN基因片段,上游 引物序列为:5 ′- CCACATGGCTAAACCCTG ACC-3′,下游引物序列为:5′-CATGGCTTTC GTTGGACTTACTTG- 3′,扩增片段126 bp。 ERK1基因片段,上游引物序列为:5′-GACTC CTACCTGAAGCATAC-3′,下游引物序列为: 5′-TCCTTGACACGCAGAATG-3′,扩增片段203 bp。VEGF基因片段,上游引物序列为:5′-CAGA AAGCCCATGAAGTGGT-3′,下游引物序列为: 5′-CTATGTGCTGGCTTTGGTGA-3′,扩增片段 250 bp。GAPDH作为内参照,上游引物序列为: 5'-TCCCATCACCATCTTCCA-3',下游引物序列 为:5'-CATCACGCCACAGTTTCC-3',扩增产物 片段376 bp。PCR 反应条件设置如下:94℃预变性 2 min,94℃变性60 s,58℃退火45 s,72℃延伸1 min,35次循环。各取5 μl PCR产物与2 μl溴酚蓝混 合后上样,1.5%琼脂糖凝胶电泳。紫外光下观察 并照相,采用软件分析目的基因和GAPDH条带的 吸光度(A)值,以同一管中目的基因和GAPDH 产物条带A值之比作为反映目的基因mRNA表达水 平的数据。 1.5.4 Western blot检测裸鼠肿瘤中OPN 、ERK1、p-ERK1、VEGF 蛋白表达
液氮磨组织提取蛋白,采用Western blot检测 OPN 、ERK1、p-ERK1/2和 VEGF 蛋白表达。一 抗OPN 、ERK1、p-ERK1和VEGF 按1:1 000稀 释,方法同前。曝光后X线片用凝胶图像分析软件 扫描,测定蛋白条带的灰度值。结果均用实际值 与内参β-actin的比值(A%)表示,每组重复实验3次。ERK1磷酸化水平用p-ERK1与ERK1比值百分 比(%)表示。 1.5.5 Western blot检测A549细胞被干预后ERK1、 p-ERK1、VEGF 蛋白表达
细胞提取总蛋白,用BCA蛋白浓度测定试剂 盒测定蛋白质浓度以保证每个上样孔总蛋白量一 致。余方法同1.5.4,每组重复实验3次。 1.6 统计学方法
数据使用SPSS17.0 统计软件分析,所有数值 以x±s表示。不同组间数据比较采用单因素方差分 析,任意两组均数之间的比较采用SNK-q检验。 P<0.05 为差异有统计学意义。 2 结果 2.1 裸鼠肿瘤体积和重量的变化
各组裸鼠均存活到实验结束,无死亡。与对 照组比较,顺铂组、小剂量西仑吉肽组、大剂量 西仑吉肽组、小剂量西仑吉肽+顺铂组和大剂量 西仑吉肽+顺铂组各组裸鼠的肿瘤体积和重量均 显著降低,差异有统计学意义(P<0.05),与顺 铂组比较,小剂量西仑吉肽+顺铂组和大剂量西 仑吉肽+顺铂组裸鼠的肿瘤体积和重量均显著降 低,差异有统计学意义(P<0.05)。与小剂量西 仑吉肽组比较,小剂量西仑吉肽+顺铂组裸鼠的 肿瘤体积和重量均显著降低,差异有统计学意义 (P<0.05),与大剂量西仑吉肽组比较,大剂量 西仑吉肽+顺铂组裸鼠的肿瘤体积和重量均显著降 低,差异有统计学意义(P<0.05),见表 1。
我们发现,顺铂对整合素β3、β5蛋白无作用 (数据未显示)。与对照组整合素β3蛋白(1.68± 0.09),整合素β5蛋白(1.78±0.12)比较,小剂量西 仑吉肽组整合素β3、β5蛋白(分别为0.79±0.03,0.87 ±0.02)、大剂量西仑吉肽组整合素β3 、β5蛋白(分 别为0.47±0.03,0.38±0.02)表达均明显降低,差 异有统计学意义(均P<0.05),提示西仑吉肽对 整合素β3、β5蛋白有抑制作用,见图 1。

|
| 1: control group; 2: cilengitide alone group(100 μg/d); 3: cilengitide alone group(200 μg /d) 图 1 西仑吉肽治疗后对整合素β3、β5蛋白抑制的影响 Figure 1 Expression of integrin β3 and β5 after treated with cilengitide |
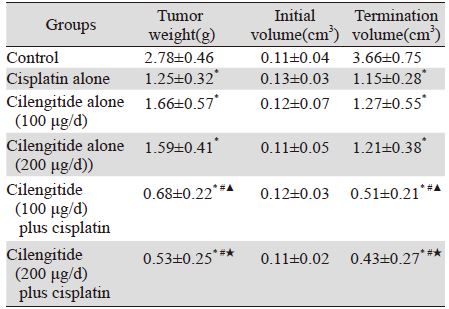
各组OPN之间比较差异无统计学意义。顺 铂组ERK1 mRNA(0.85±0.05)和VEGF mRNA (0.75±0.06)与对照组ERK1 mRNA(0.89±0.06) 和VEGF mRNA(0.76±0.08)比较,差异无统计 学意义,小剂量西仑吉肽组、大剂量西仑吉肽组 ERK1 mRNA(分别为0.51±0.07,0.40±0.05)、 VEGF mRNA(分别为0.43±0.05,0.35±0.02)表 达均明显降低,差异有统计学意义(均P<0.05), 提示西仑吉肽对ERK1 mRNA和VEGF mRNA有 抑制作用。与小剂量西仑吉肽组和单纯顺铂组比 较,小剂量西仑吉肽+顺铂组ERK1 mRNA(0.33± 0.04)和VEGF mRNA(0.22±0.03)表达更低,差 异有统计学意义(均P<0.05);与大剂量西仑吉 肽组和单纯顺铂组比较,大剂量西仑吉肽+顺铂组 ERK1 mRNA(0.28±0.05)和VEGF mRNA(0.19± 0.03)更低,差异有统计学意义(均P<0.05),提 示西仑吉肽与顺铂一起有协同降低ERK1 mRNA 和 VEGF mRNA表达的作用,见图 2。
|
| M: Marker; 1: control group; 2: cisplatin alone group; 3: cilengitide alone group (100 μg/d); 4: cilengitide alone group(200 μg/d); 5: cilengitide (100 μg/d) plus cisplatin group; 6:cilengitide (200 μg/d) plus cisplatin group 图 2 各组裸鼠肿瘤中OPN、ERK1和VEGF mRNA表达 Figure 2 mRNA expression levels of OPN, ERK1 and VEGF in each group |
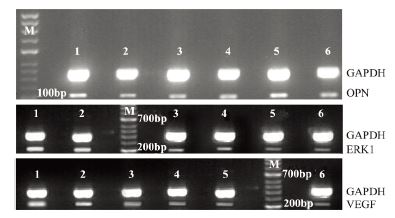
各组OPN之间比较差异无统计学意义。顺 铂组ERK1蛋白磷酸化(83.7±2.5)、VEGF 蛋 白(58.6±2.7)表达与对照组ERK1蛋白磷酸化 (87.9±3.5)和VEGF蛋白(59.2±3.9)比较,差 异无统计学意义,小剂量西仑吉肽组、大剂量西 仑吉肽组ERK1蛋白磷酸化(分别为61.6±2.7, 52.5±2.4)、VEGF 蛋白(分别为42.1±1.2,36.7 ±2.3)表达均明显降低,差异有统计学意义(均 P<.05),提示西仑吉肽对p-ERK1和VEGF蛋白 有抑制作用。与小剂量西仑吉肽组和单纯顺铂组 比较,小剂量西仑吉肽+顺铂组ERK1蛋白磷酸 化(33.8±1.1)和VEGF蛋白(17.4±1.3)表达更 低,差异有统计学意义(均P<0.05),与大剂量 西仑吉肽组和单纯顺铂组比较,大剂量西仑吉肽 +顺铂组ERK1蛋白磷酸化(27.0±1.6)和VEGF (15.6±1.1)表达更低,差异有统计学意义(均 P<0.05),提示西仑吉肽不仅对p-ERK1和VEGF 蛋白有抑制作用,而且与顺铂有协同抑制p-ERK1 和VEGF 蛋白作用,见图 3。
|
| 1: control group; 2: cisplatin alone group; 3: cilengitide alone (100 μg/d) group; 4: cilengitide alone (200 μg/d) group; 5: cilengitide (100 μg/d) plus cisplatin group; 6: cilengitide (200 μg/d) plus cisplatin group 图 3 各组裸鼠肿瘤中OPN 、ERK1磷酸化水平和VEGF蛋 白表达 Figure 3 The expression levels of OPN, phosphorylated ratio of ERK1, VEGF protein in each group |
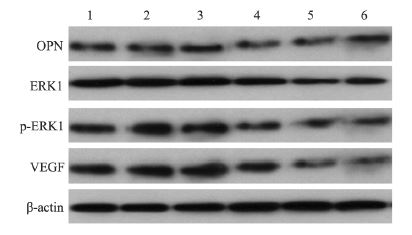
与对照组(8 9 .5 ± 6 .0)比较,西仑吉肽组 p-ERK1蛋白表达下降,ERK1磷酸化水平(61.3 ±5.9)下降,EGF刺激后p-ERK1蛋白表达增加, ERK1磷酸化水平(101.2±7.3)增加,PD98059作 用后p-ERK1蛋白表达明显降低,ERK1磷酸化水平 (42.5±3.7)下降;与EGF组(101.2±7.3)比较, 西仑吉肽+EGF组p-ERK1蛋白表达下降,ERK1 磷酸化水平(68.9±5.5)下降,EGF+PD98059组 p-ERK1蛋白表达下降,ERK1磷酸化水平(70.5 ±4.6)下降,提示西仑吉肽与PD98059具有类似 作用可以抑制EGF刺激后p-ERK1蛋白表达增加, ERK1磷酸化水平增加。
与对照组(0.89±0.08)比较,西仑吉肽组 VEGF 蛋白(0.51±0.07)表达下降,bFGF 刺激 后VEGF蛋白(1.09±0.06)表达增加,SU5416 作用后VEGF 蛋白(0.29±0.03)表达明显降低; 与bFGF组比较,西仑吉肽+ bFGF 组VEGF 蛋白 (0.58±0.03)表达下降,bFGF+SU5416组VEGF 蛋白(0.42±0.05)表达下降,提示西仑吉肽和 SU5416都可以抑制bFGF刺激后VEGF蛋白表达增 加,见图 4。
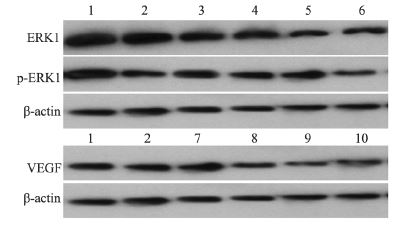
|
| 1: control group; 2: cilengitide group; 3: EGF group; 4: cilengitide plus EGF group; 5: EGF plus PD98059 group; 6: PD98059 group;7: bFGF group; 8: cilengitide plus bFGF group; 9: bFGF plus SU5416 group;10: SU5416 group; EGF: ERK1 agonist epidermal growth factor; bFGF: VEGF agonist basic fibroblast growth factor 图 4 A549细胞中ERK1磷酸化、VEGF蛋白表达 Figure 4 Phosphorylated ratio of ERK1 and VEGF protein expression in A549 cells |
整联蛋白是一类广泛存在于细胞膜表面的膜 受体家族,其中αvβ3和αvβ5对内皮细胞生存和迁 移有重要作用[5]。如果阻断内皮细胞表面特异性 αvβ3和αvβ5整合蛋白,可以阻止内皮细胞增殖和 迁移,破坏新生血管形成,因此近年研究认为针 对整联蛋白,特别是与血管生成和实体瘤转移有 关的整联蛋白的治疗,有可能成为今后肿瘤治疗 的靶点。细胞外信号调节蛋白激酶(extracellular signal-regulated kinase, ERK)通道是一种重要的细 胞内信号转导通道,该通路是Ras、PKC、PKA、 G蛋白、酪氨酸蛋白磷酸酶和丝/苏氨酸蛋白磷酸 酶等多条信号通路的会聚点,参与多种细胞异常 增殖与分化的信号调控。VEGF是目前公认促血管 生成作用最强的因子之一,在多数恶性肿瘤中都 发现VEGF表达增高,肿瘤的生长与肿瘤血管生成 密切相关。SU5416是血管内皮细胞受体磷酸化作 用的抑制剂,在体内外实验中均显示SU5416可抑 制肿瘤细胞生长、微血管生成,增加肿瘤细胞凋 亡。我们前期研究已发现,整合素α5β1的抗体和 siRNA双链均可以通过下调ERK的mRNA和蛋白表 达,并抑制其磷酸化水平从而明显抑制A549细胞 的增殖,促进细胞凋亡、细胞内caspase-3蛋白表达 和抑制细胞内MMP-9蛋白表达,因此整合素α5β1可 能通过介导的ERK信号转导通路参与了非小细胞肺 癌中A549细胞的异常增殖和迁移调控[6-7]。西仑吉 肽模拟多肽cyclo(RGDfV)的结构,是可以抑制 αvβ3和αvβ5整联蛋白的小分子化合物[8],目前国外 正在进行西仑吉肽治疗恶性胶质瘤、脑和中枢神 经系统癌症等临床研究[9-10],有关西仑吉肽治疗肺 癌的研究尚少,西仑吉肽是否会通过ERK信号通 路和VEGF发挥抑制肺癌生长的作用,目前亦研究 较少,我国目前尚未开展西仑吉肽在肺癌的临床 研究。为进一步确认西仑吉肽在体内对于NSCLC 生长的影响,及其与顺铂联用的抑瘤作用,本课 题对西仑吉肽及其与顺铂联用抑制NSCLC裸鼠移 植瘤生长进行了研究。
我们的研究显示,西仑吉肽治疗后裸鼠的肿瘤 体积和重量均显著降低,提示西仑吉肽对NSCLC 裸鼠移植瘤生长有明显抑制作用。Hu等[11]研究显 示NSCLC肿瘤组织OPN阳性表达率明显升高,且 与肿瘤的大小、分期和转移相关。本研究显示, 西仑吉肽对整合素β3、β5蛋白有抑制作用,且西 仑吉肽对于整合素β3、β5蛋白抑制效应与剂量 一致。西仑吉肽是否通过OPN和整联蛋白发挥作 用?我们进一步研究发现西仑吉肽对OPN并无作 用,西仑吉肽治疗后ERK1 mRNA和蛋白的表达明 显降低,西仑吉肽治疗后VEGF mRNA和蛋白的表 达也明显降低,提示西仑吉肽可能通过抑制整合 素β3、β5蛋白,调节下游ERK信号通路,使得实 体瘤生长受到抑制;而且西仑吉肽在抑制ERK信 号通路的同时可能也抑制VEGF依赖性的肿瘤新生 血管形成,从而在抑制血管生成和实体瘤生长两 方面发挥作用。为此,我们进一步以肺癌A549细 胞为研究对象,观察西仑吉肽、ERK激动剂和抑 制剂、VEGF激动剂和抑制剂对A549细胞p-ERK1 和VEGF蛋白表达的影响。研究显示,当用EGF和 bFGF激活p-ERK1和VEGF蛋白表达增强后,再予 以西仑吉肽处理,A549细胞中p-ERK1和VEGF蛋 白表达下降,提示西仑吉肽可以通过抑制ERK1活 化和VEGF生成来抑制肿瘤细胞的生长。
目前,放化疗是NSCLC的主要治疗手段, 顺铂是肺癌临床治疗的首选药物。它是细胞周期 非特异性药物,可以和细胞内碱基结合,造成 DNA结构和功能损伤,促进细胞凋亡,但常易 引发耐药而致预后较差,而且其毒性反应所导致 的低耐受性也限制了临床应用。因此,寻找低毒 安全的化疗方案是临床上NSCLC治疗的一个重 要方向。本研究结果显示,西仑吉肽联合顺铂作 用后,移植瘤的生长明显受抑制,且与单纯顺铂 组和单纯西仑吉肽治疗组相比,差异有统计学意 义(P<0.05)。此外,西仑吉肽联合顺铂作用后 ERK1、VEGF mRNA和蛋白的表达也明显降低, 与单纯顺铂组和单纯西仑吉肽治疗组相比,差异 有统计学意义(P<0.05),提示西仑吉肽能协同 增强顺铂的作用对NSCLC细胞生长抑制,其机制 可能与阻断ERK1信号活化和VEGF生成有关。这 种联合治疗有望在提高疗效的同时,降低顺铂的 不良反应和耐药性的产生。
综上所述,西仑吉肽抑制肺腺癌A549细胞裸 鼠移植瘤模型中,西仑吉肽不仅本身具有一定的 抑瘤作用,而且可增强顺铂抑瘤作用,其作用机 制可能与西仑吉肽抑制ERK1活化作用和VEGF生 成有关。这一研究为肺腺癌治疗提供实验依据, 但其临床应用仍是—个需要解决的问题。因此有 必要深入研究这类新药的最佳治疗方案,比如如 何筛选可能对该种靶向治疗有效的患者群,或这 类药物相互之间或与手术、化放疗之间的最佳联 合方案。
| [1] | Es k e n s FA, Du me z H, Ho e k s tr a R, e t a l. P h a s e I a n d pharmacokinetic study of continuous twice weekly intravenous administration of Cilengitide (EMD 121974), a novel inhibitor of the integrins alphavbeta3 and alphavbeta5 in patients with advanced solid tumours [J]. Eur J Cancer, 2003, 39(7): 917-26. |
| [2] | Liu XF, Xia YF, Li MZ, et al. The effect of p21 antisense oligodeoxynucleotides on the radiosensitivity of nasopharyngeal carcinoma cells with normal p53 function [J]. Cell Biol Int, 2006, 30(3): 283-7. |
| [3] | Deng L, Zhang XZ, Wang WD, et al. Recombinant human endostatin combined with paclitaxel-cisplatin chemotherapy in treatment of human breast cancer xenograft in nude mice[J]. Di San Jun Yi Da Xue Xue Bao, 2008, 30(9): 783-6. [邓莉, 张轩珍, 王卫东, 等. 重组人内皮抑素联合紫杉醇+顺铂化疗方案治疗人 乳腺癌裸鼠移植瘤的研究[J]. 第三军医大学学报, 2008, 30(9): 783-6.] |
| [4] | Yamada S, Bu XY, Khankaldyyan V, et al. Effect of the angiogenesis inhibitor Cilengitide (EMD 121974) on glioblastoma growth in nude mice[J]. Neurosurgery, 2006, 59(6): 1304-12. |
| [5] | Huveneers S, Truong H, Danen HJ. Integrins: signaling, disease, and therapy[J]. Int J Radiat Biol, 2007, 83(11-12): 743-51. |
| [6] | Bai J, Zhong XN, Tang HJ, et al. Effect of α5β1 integrin and ERK signaling pathway on Non-small Cell Lung Cancer[J]. Zhongguo Zhong Liu Ling Chuang, 2011, 38(22):1370-5.[白晶, 钟小宁, 唐 海娟, 等.整合素α5β1和细胞外信号调节激酶信号传导通路在 非小细胞肺癌中的作用及其相关性研究[J]. 中国肿瘤临床, 2011, 38(22): 1370-5.] |
| [7] | Bai J, Zhong XN, Tang HJ, et al. Effect of integrin α5β1-mediated ERK signal pathway on proliferation and migration of A549 cells[J]. Zhongguo Fei Ai Za Zhi, 2011, 14(7): 568-74. [白晶, 钟 小宁, 唐海娟, 等. 整合素α5β1介导细胞外信号调节激酶信号转 导通路对A549细胞生长和侵袭的影响[J]. 中国肺癌杂志, 2011, 14(7): 568-74.] |
| [8] | Loges S, Butzal M, Otten J, et al. Cilengitide inhibits proliferation and differentiation of human endothelial progenitor cells in vitro[J]. Biochem Biophys Res Commun, 2007, 357(4): 1016-20. |
| [9] | Kim KB, Prieto V, Joseph RW, et al. A randomized phase II study of cilengitide (EMD 121974) in patients with metastatic melanoma[J]. Melanoma Res, 2012, 22(4): 294-301. |
| [10] | MacDonald TJ, Stewart CF, Kocak M, et al. Phase I clinical trial of cilengitide in children with refractory brain tumors: Pediatric Brain Tumor Consortium Study PBTC-012[J]. J Clin Oncol, 2008, 26(6): 919-24. |
| [11] | Hu Z, Lin D, Yuan J, et al. Overexpression of osteopontin is associated with more aggressive phenotypes in human non-small cell lung cancer[J]. Clin Cancer Res, 2005, 11(13): 4646-52. |
 2014, Vol. 41
2014, Vol. 41