2.眼科研究所,
3.神经外科三
2. Ophthalmological Research Institute,
3.Three Department of Neurosurgery
2.Department of Hepatobiliary Surgery,
3.Department of Spleen and Stomach Diseases,Chinese Medicine Hospital of Hebei Province;
4.Department of Minimally Invasive Surgery,The Second Hospital of Hebei Medical University
脑胶质瘤既是颅内最常见的原发性恶性肿 瘤,也是人体中血管化程度最高的肿瘤之一。迄 今为止,因缺乏有效的治疗方法,患者平均生存 期不到1年[1]。脑胶质瘤的发生也是一个多基因 参与的多阶段的发生发展过程,基因水平决定着 胶质瘤的发生与发展,对胶质瘤进展相关基因的 探索及其发病和分子机制的深入研究将为发现 新的分子疗法和靶向治疗提供依据。已有研究 发现[2, 3],抑癌基因P53、PTEN/DMBTl的缺失或 突变,EGF/EGFR和VEGF/VEGFR过表达,以及 PDGF-PDGFR、RB、PI3K/AKT、Notch、JAKSTAT 、MAPK、Wnt/β- catenin、 BMPs- Smads信 号通路的改变等分子基因水平的改变与胶质瘤发 生发展相关联,并相互之间存在着错综复杂的串 话机制(cross talking),对脑胶质瘤的发展起到 正调控或负调控的作用。为此,我们在检测脑胶 质瘤BMP2、BMP4的基础上应用反转录-聚合酶 链式反应(Reverse Transcription-Polymerase Chain Reaction,RT-PCR)技术和免疫组织化学染色 SABC(Strept Actividin-Biotin Complex)法,检 测BMPs/BMPR/Smads通路中关键分子Smad-1、 Smad-2 和 Smad-4的mRNA及其蛋白在正常脑组 织和脑胶质瘤组织中的表达, 探讨其在脑胶质瘤 组织中的表达及其与脑胶质瘤临床分级的关系。 1 资料与方法 1.1 研究对象
收集河南省人民医院脑外科2009年1月—2010 年11月手术切除的新鲜人脑胶质瘤标本40例,年 龄最小为 17 岁,最大64 岁,其中男 26 例,女14 例。患者均为第一次接受手术治疗,且术前均未 行任何放疗和化疗,术后均经病理学切片证实为 胶质瘤。按照WHO脑肿瘤分类标准确定为Ⅰ级胶 质瘤13例,Ⅱ级胶质瘤9例,Ⅲ级胶质瘤11例, Ⅳ级胶质瘤7例。另取脑外伤患者行内减压手术 而取得的新鲜正常脑组织20例作为对照组。从手 术室取得的新鲜标本,切取瘤体中心部位组织, 除部分留作常规病理诊断和免疫组织化学外,其 余组织用无RNA酶去离子水处理后置于液氮中保 存,作RT-PCR检测备用。 1.2 主要仪器与试剂
PCR仪为美国PE公司2720型产品。DNA Marker、Taq DNA聚合酶及一步法RT-PCR试剂盒 均购于大连宝生物公司;琼脂糖为Oxoid公司产 品;Trizol为Invitrogen公司产品;DAB显色剂购 于北京中杉金桥公司;兔抗人Smad-1、Smad-2和 Smad-4三种一抗均为多抗产品,均购自美国AB 公司;二抗为羊抗兔IgG-HRP,由博迈德公司生 产;其他试剂均为国产分析纯。RNA提取所用的 实验耗材、去离子水均为Axygen公司生产的无 RNA酶产品。 1.3 引物序列
由GenBank查找人Smad-1(GenBank Accession Number: NM_001003688) 、 S m a d - 2 ( G e n B a n k A c c e s s i o n N u m b e r : NM_001135937.1)、Smad-4(GenBank Accession Number: NM_005359.5)及内参照GAPDH (GenBank Accession Number: NM_002046.3)基 因序列,利用Primier5.0软件自行设计,进行特异 性和唯一性分析后由北京三博远志生物技术有限 责任公司DNA合成,其序列见表1。
|
|
表1 Smads RT-PCR扩增引物 Table1 Smads RT-PCR Primers |
严格按照Trizol说明书进行操作,用紫外分光 仪测定RNA浓度,并保证A260/A280≥1.8。 1.4.2 cDNA的合成
根据北京三博远志生物技术有限责任公司 DNA合成报告单合成,本OligoDNA是以OD260 为单位来计量的,是指在1 ml体积1 cm光程标 准比色皿中,260 nm波长下吸光度为1A260 nm 的Oligo溶液定义为1OD260单位。根据此定义, 1OD260单位相当于33 μg的OligoDNA,本公司提 供的序列报告中分子量计算公式如下:MW=(A 碱基数×312)+(G碱基数×288)+(T碱基数× 303)-61。 1.4.3 PCR扩增
取第一链cDNA 2 μl,依次加入10 pM下游引物 各2 μl、dNTP4 μl、2 u/μl Taq 酶1 μl、10×PCR buffer 5 μl后,再加入36 μl 无RNA酶去离子水 H2O,轻 轻混匀构建50 μl扩增体系。反应条件为95℃预变 性5 min,94℃ 1 min,55℃ 40 s,72℃ 50 s,进行35个循环,72℃延伸7 min。取PCR产物约5 μl 用1.2%琼脂糖凝胶电泳,紫外透照下观察结果, 并拍照。 1.4.4 PCR产物半定量分析
将电泳凝胶置于Gel Doc2000凝胶图像分析系 统进行灰度体积积分分析,以各自内参照的灰度 值为参照,每张图片的每个指标重复6次进行灰 度体积积分测定,取其平均值来反映mRNA的表 达水平。 1.5 免疫组织化学分析 1.5.1 免疫组织化学反应
所有反应均在湿盒中进行。将石蜡切片常规 脱蜡入水后,用pH6.0柠檬酸缓冲液煮沸法进行 抗原修复,0.3% H2O2消除内源性过氧化氢酶, 10% BSA室温封闭,滴加稀释后的一抗(l∶100) 置湿盒中4℃过夜,空白对照用等量的PBS替代一 抗,次日滴加生物素过氧化物酶复合物,室温孵 育1 h;用含0.3% H2O2的DAB液显色5 min左右终 止反应,室温下光镜监视其显色、镜检。 1.5.2 结果判断
镜下观察各组进行免疫组织化学反应的标 本,以胞质内出现清晰可见的棕黄色或棕色颗粒 为免疫组织化学阳性信号,计为表达相应蛋白的 阳性细胞。按照文献[2]报道的人工计数法,每张 标本于高倍镜(×400)下随机选取10个互不重叠 的视野,统计阳性细胞百分率即阳性细胞占同类 细胞的百分比,以阳性细胞百分率≥10%者为阳 性表达,阳性细胞百分率<10%为阴性表达。部 分切片染色呈棕黄色染色连成片状不易鉴别者, 阳性细胞百分率计算方法为:(高倍镜下棕黄色染 色面积÷该高倍镜视野总面积)×100%。最后再计 算每组标本的总体阳性率。总体阳性率(%)= (本组阳性标本总数÷本组标本总数)×100%。 1.6 统计学方法
用SPSS 17.0 统计软件对检测结果进行统计分 析,以α=0.05为检验水准,对相关数据采用χ2或t 检验进行比较分析。 2 结果
RT-PCR扩增结果显示,Smad-1、Smad-2、 Smad-4三者的mRNA在胶质瘤组织中表达显著低 于正常脑组织,且Ⅲ+Ⅳ组显著低于Ⅰ+Ⅱ组。 免疫组织化学染色结果显示,Smad-1、 Smad-2、Smad-4蛋白质表达主要定位于正常脑组 织和脑胶质瘤细胞的细胞质中,呈弥漫分布的棕 色或棕黄色颗粒,强弱不等。蛋白质表达的阳性 率显著低于正常脑组织,且Ⅲ+Ⅳ组显著低于Ⅰ+ Ⅱ组。而Smad-1、Smad-2、Smad-4三者蛋白质表 达的阳性率在不同年龄组及不同性别组患者之间 差异无统计学意义,见图1、2,表2、表3。
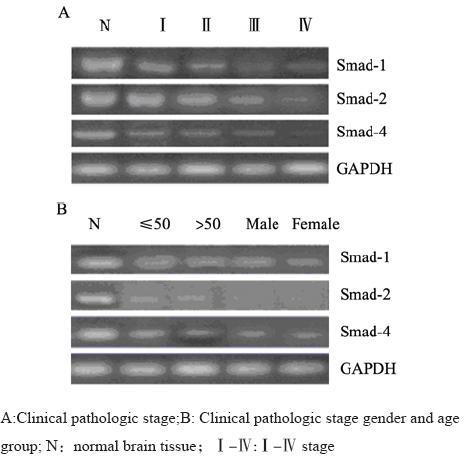 |
图1 Smads RT-PCR电泳图 Figure1 Electrophoretic pattern of Smads after RT-PCR |
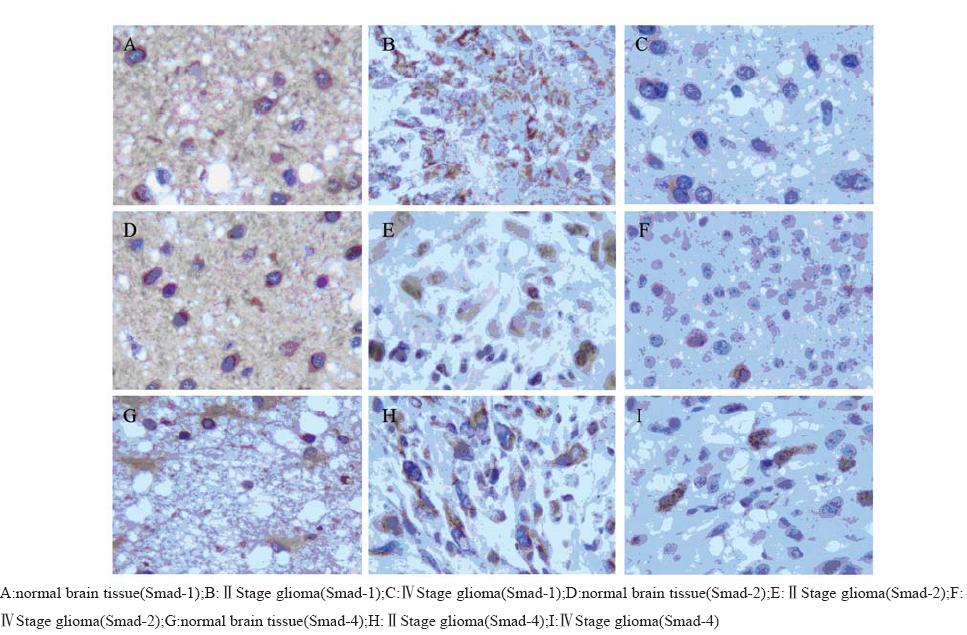 |
图2 Smad-1、Smad-2、Smad-4 蛋白在正常脑组织和脑胶质瘤组织中的表达(IHC ×200) Figure2 Expression of protein of Smad-1,Smad-2,Smad-4 in human glioma and normal brain tissue(IHC ×200) |
|
|
表2 Smad-1,Smad-2和Smad-4 mRNA在正常脑组织和脑胶质瘤组织中的表达(灰度值,x±s) Table2 Expression of Smad-1,Smad-2 and Smad-4 mRNA in Human Glioma(Gray value,x±s) |
|
|
表3 Smad-1/2/4蛋白在正常脑组织和脑胶质瘤组织中的表达(标本总体阳性率,%) Table3 Expression of Smad-1/2/4 Protein in human glioma and normal brain tissues (the total positive rate of specimens,%) |
Smads蛋白属于转录因子TGF-β超家族,最早 发现于果蝇细胞内的Mad(mothers against dpp) 蛋白和线虫的Sma蛋白,并因此而命名为Smads, 其在TGF-β超家族的细胞内信号传递发挥着非常 重要的作用。目前,在哺乳动物体内已发现主要 有Smad-1~8八个成员,按其功能差异可分为三 类:受体调节型Smads(receptor-regulated Smads, R-Smads)、公用介体型Smads (common-mediator Smads,Co-Smads)和抑制型Smads(inhibitory Smads,I-Smads)[4, 5, 6]。从分子结构上看,Smads蛋 白拥有保守的N末端(MAD Homology 1,MH1) 和C末端(MAD Homology 2,MH2),两者之间 的连接区是非保守的苏氨酸、丝氨酸与脯氨酸。 MH1区是DNA结合的结构区,MH2区则是Smads 蛋白的效应区。两者处于基础状态时互相结合 并抑制对方的功能。R-Smads梭基末端的丝氨酸 被BMPI型受体磷酸化,同时激活的R-Smads/Co- Smads转录复合物形成并转位入核内,再通过与 各类共激活因子或抑制因子结合而调控下游靶基 因的转录。
目前认为[7],Smad-1、2属于R-Smads,而 Smad-4是目前唯一在哺乳动物细胞中发现的Co- Smad。Smad-1的主要作用是由BMPI型受体激 活后负责BMPs的信息传导;Smad-2由activin和 TGF-βI型受体激活后主要介导TGF-β和Activin信 号转导,而对BMP-2则无反应,TGF-β和Activin 亦不能诱导Smad-1磷酸化;而Smad-4是作为 BMPs和TGF-β/activin两条信号途径共用的转录因 子存在,特别是对TGF-β信号的转导具有较强的 控制作用;同时,Smad-4还表现为其他Smads的伙伴,与活化的R-Smads结合为异聚体后从细胞 质向细胞核移行,在细胞核内调控下游靶基因的 表达,进而改变细胞的生物学特性。
此外,大量研究证实[8, 9, 10, 11, 12, 13],某些Smads基因 的突变、失活、异常表达,以及因泛素化等原 因引起的Smads蛋白的功能丧失与许多肿瘤的发 生、发展、浸润及转移等相关,如有研究结果提 示[7],胶质瘤的发生和恶性进展过程中,伴有磷 酸化Smad-1(phosphorylated-Smad-1,P-Smad-1) 的磷酸化活化障碍, Smad-1的蛋白表达随着胶 质瘤恶性级别的增高而降低。已有人从体外研 究证实了这一点[14],其结果显示,磷酸化Smad- 1(phosphorylated-Smad-1,P-Smad-1) 可抑制胶母 细胞瘤细胞系U251的增殖,诱导瘤细胞的分化和 凋亡,其蛋白表达随着胶质瘤恶性级别的增高而 降低。
本研究显示,与正常脑组织相比,脑胶质瘤 组织中Smad-1、Smad-2、Smad-4 mRNA和蛋白表 达水平显著降低(P<0.05),并随着肿瘤恶性级 别的增高而降低,Ⅲ+Ⅳ组与Ⅰ+Ⅱ组之间差异有 统计学意义(P<0.05),与已有研究[15, 16]结果相近。 另外,Smad-1、Smad-2、Smad-4在人脑胶质瘤组 织中随病理分级的增加而表达减少(P<0.05),也 反映出人脑胶质瘤组织中与癌组织的分化有着明 显的关系,分化越低,其表达越少。我们分析, 可能是因为其上游的BMPRⅠa 、BMPRⅠb、 BMPR Ⅱ三种受体的表达降低,BMPs无法发挥 调控其表达所致;而正是因为Smad-1、Smad-2、 Smad-4的表达降低,直接失去了其自身或间接失 去了其他细胞信号转导通路对细胞的增殖抑制和 促进其分化、凋亡的作用,而导致了肿瘤的发生 与向恶化进展。比如除了直接丧失了Smad-1的作 用外,也可能因为Smad-2、Smad-4蛋白的表达 缺失,导致细胞逃脱TGF-β的抑制作用,促进了 人脑胶质瘤的发生,并在已发生癌变的组织中继 续参与人脑胶质瘤的侵袭及演进。由于Smad-1、 Smad-2、Smad-4在脑胶质瘤组织中,是随着胶质 瘤的发生和病理分级同步降低的,我们认为三者 可能对胶质瘤的发生和发展起着相同的作用。
| [1] | Yang T,Zhang X,Zhou L,et al.Expression and Signifi cance f p57kip2 and p21cip1 in Human Glioma[J].Xi’an Jiao Tong Da ue Xue Bao(Yi Xue Ban),2008, 29(5): 562-5.[杨涛,张熙,周 ,等. p57kip2和p21cip1 在人脑胶质瘤中的表达和临床意义 | |
| [2] | Amos S,Redpath GT,Polar G,et al.Farnesylthiosalicylic acid nduces caspase activation and apoptosis in glioblastoma cells[J]. ell Death Differ,2006,13(4):642-51. | |
| [3] | Parsa AT,Waldron JS,Panner A,et al.Loss of tumor suppressor TEN function increase B7-H1 expression and immunoresistance n glioma[J]. Nat Med,2007,13(1):84-8. | |
| [4] | MassaguéJ .How cells read TGF-beta signals[J].Nat Rev Mol Cell iol,2000,1 (3):169-78. | |
| [5] | Zhang WL,Sun WW,Bu LS,et al.Smad protein families and BMPs ignaling transduction [J].Zhongguo Di Fang Bing Xue Za Zhi, 002,21(4):325-6.[张文岚,孙文伟,卜丽莎,等.Smad蛋白 族与骨形态发生蛋白信号传导[J].中国地方病学杂志, 002,21(4):325-6.] | |
| [6] | Li L,Xin H,Xu X,et al.CHIP mediates degradation of Smad roteins and potentially regulates Smad-induced transcription[J]. ol Cell Biol,2004,24(2):856-64. | |
| [7] | Song XX.Bone morphogenetic proteins in basic study and linical application[J].Xian Dai Yi Yao Wei Sheng, 2007,23(7): 003-4.[宋兴贤.骨形态发生蛋白的基础研究及临床应用[J].现代医药卫生,2007,23(7): 1003-4 | |
| [8] | Xiangming C, Natsugoe S, Takao S, et al.Preserved Smad4 xpression in the transforming growth factor beta signaling athway is a favorable prognostic factor in patients with advanced astric cancer [J]. Clin Cancer Res,2001,7(2):277-82. | |
| [9] | Piestrzeniewicz Ulanska D,Brys M,Semczuk A,et al. Expression nd intracellular localization of Smad proteins in human ndometrial cancer[J].Oncol Rep, 2003,10(5):1539-44. | |
| [10] | Derynck R, Zhang YE. Smad-dependent and Smad-independent athways in TGF-beta family signalling[J]. Nature,2003,425(695 ):577-84. | |
| [11] | Nicolás FJ, Hill CS. Attenuation of the TGF-beta-Smad signaling ath way in pancreatic tumor cells confers resistance to TGF-betainduced rowth arrest [J]. Oncogene,2003,22(24):3698-711. | |
| [12] | Maliekal TT,Antony ML,Nair A,et al. Loss of expression,and utation of Smad-2 and Smad-4 in human cervical cancer[J]. ncogene 2003,22(31):4889-97. | |
| [13] | Kim YH, Lee HS, Lee HJ, et al.Prognostic significance of the xpression of Smad4 and Smad7 in human gastric carcinomas [J]. nn Oncol,2004,15(4):574-80. | |
| [14] | Liu S. Glioma BMPs/Smad, signal paths in the expression and unction of the study[D]. Beijing:Academy of Military Medical ciences, 2007. [刘爽. 胶质瘤中BMPs/Smad信号路径的表达及 能研究[D].北京:军事医学科学院,2007.] | |
| [15] | Rosenzweig BL, Imamura T, Okadome T, et al. Cloning and haracterization of a human type II receptor for bone morphogenetic roteins[J]. Proc Natl Sci U S A,1995,92(17):7632-6. | |
| [16] | Shao BY, Chen QX, Liu G, et al. Expression and Effects of mad4 and Smad7 in Human Glioma[J]. Zhong Liu Fang Zhi an Jiu,2005,32(3):132-4.[邵步云,陈谦学,刘刚,等. Smad4 Smad7在人脑胶质瘤中的表达及意义[J]. 肿瘤防治研究 ,2005,32(3):132-4.] |
 2014, Vol.41
2014, Vol.41