-
摘要:目的
探索阿帕替尼在晚期肝癌的一线治疗效应。
方法对2017年7月至2020年1月在武汉大学人民医院肿瘤中心治疗的晚期肝癌患者进行回顾性分析,纳入35例肝癌患者,所有患者均给予甲磺酸阿帕替尼片250~500 mg口服,每天1次。对于疾病控制有效的患者(包括CR、PR和SD)继续给药直至PD或无法耐受或死亡。主要终点为PFS和OS,次要终点为DCR、ORR,同时观察不良反应。
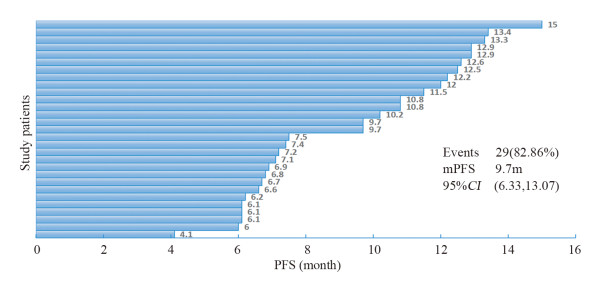
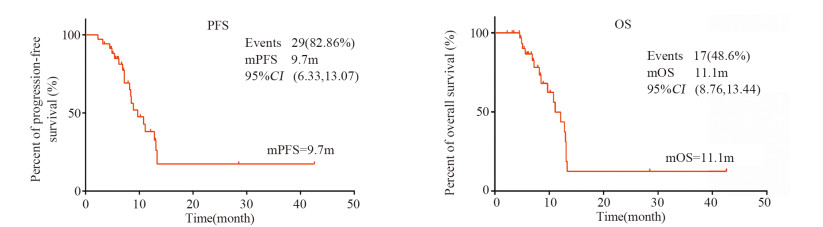
结果CR 1例,PR 17例,SD 11例,ORR 51.43%,DCR 82.86%,中位PFS 9.7月,中位OS 11.1月。患者的主要不良反应有手足综合征、高血压、蛋白尿等,大多3~5级不良反应均可逆,安全性好。
结论阿帕替尼可以改善肝癌患者的临床获益、安全有效,是晚期肝癌可选择的一线方案。
Abstract:ObjectiveTo explore the effect of apatinib in first-line treatment of advanced liver cancer.
MethodsRetrospective analysis was performed on 35 patients with advanced liver cancer treated in our department from July 2017 to January 2020. All patients were given apatinib mesylate tablet 250-500 mg orally with QD. The patients with effective disease control (including CR, PR and SD) were given administration until PD or intolerance or death occurred. The primary endpoints were PFS and OS, and the secondary endpoints were DCR and ORR. The side effect was observed.
ResultsThere was one case of CR, 17 cases of PR and 11 cases of SD. The ORR and DCR were 51.43% and 82.86%. The median PFS and OS were 9.7 and 11.1 months. The main adverse reactions included hand-foot syndrome, hypertension, proteinuria, etc. Most grade 3-5 adverse reactions were reversible with good safety.
ConclusionApatinib can significantly improve the clinical benefits of liver cancer patients. It is an alternative first-line treatment for advanced liver cancer.
-
Key words:
- Apatinib /
- Liver cancer /
- First-line treatment
-
0 引言
传统膀胱镜检查(conventional cystoscopy/white light cystoscopy,WLC)是诊断和监测膀胱癌患者的“重要手段”。尽管术后联合辅助化疗可以提高膀胱癌患者的生存率,但其复发带来的定期复查给患者带来很大痛苦,并增加患者家庭经济成本[1, 2]。目前,泌尿外科医生常通过WLC来区分良恶性组织,但仅依靠视觉进行肿瘤诊断、分级或侵袭水平的判断并不可靠。膀胱镜检查假阳性结果可能导致不必要的膀胱活组织切片检查,而假阴性将导致残余肿瘤或未被发现的原位癌(carcinoma in situ,CIS)进一步进展,并给患者带来复发的风险。电荷耦合器远端芯片的传感器与高清画面结合代表新型内镜成像时代的到来,达到对膀胱局部组织更好的可视化效果,可成为提高膀胱肿瘤诊断率的辅助工具。目前新型内镜成像技术包括荧光膀胱镜检查、窄带成像技术、光学相干断层扫描、共聚焦激光显微内镜等,本文将就新型内镜成像技术及其在提高膀胱癌诊断率等方面的应用进展进行综述。
1 光动力诊断/荧光膀胱镜检查[photodynamic diagnosis(PDD)/fluorescence cystoscopy(FC)]
光动力学诊断(PDD)是一种比较成熟的膀胱镜检查技术。术前膀胱灌注的光敏剂优先被异常的尿路上皮细胞摄取并代谢,当暴露在蓝光(380~480 nm)时会发出特色的红色荧光[3]。目前PDD的光敏剂有5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)、氨基己糖氨基酮戊酸盐(hexaminolevulinate,HAL)。HAL与5-ALA相比具有较好的脂溶性、较高的局部生物利用度、较强的稳定性及优异的荧光强度。Stenzl等发现在经尿道膀胱肿瘤切除术(TURBT)后降低复发风险方面,HAL-PDD相比WLC可相对减少16%[4]。
临床研究证实HAL-PDD能够非常准确地识别CIS及提高肿瘤完全切除率。在CIS检出率上,2项荟萃分析为这一结论提供了更强有力的证据[5, 6],其中一项报道,HAL-PDD与WLC分别为87%和75%,差异具有统计学意义(P=0.006),表示其对隐匿性CIS是一种有效的诊断工具[6]。在提高肿瘤病灶完全切除率方面,也有多项研究表明HAL-PDD能降低肿瘤复发的潜在风险[4, 7, 8, 9]。如Burger等发现HAL-PDD5-ALA-PDD在减少TURBT术后残余癌及降低潜在复发方面优于WLC,但前两者之间并无差异[10]。
目前,临床试验[3, 8, 11]证明在围手术期指导使用单一剂量膀胱内化疗方面,HAL-PDD对患者也可能存在一定的益处。Geavlete等[8]发现在HAL-PDD组和WLC组中,中度风险的患者均接受丝裂霉素C膀胱内化疗,高风险的均接受BCG灌注;两组在1、2年复发率上表现出显著的差异,分别为21.6%、32.5%(P=0.005)与31.2%、45.6%(P=0.001)。然而,这与O'Brien及Gkritsios的研究结果相反[3, 11]。这一现象可能与化疗药物杀死了部分WLC漏检的体积小且隐匿性残留的癌细胞,及选择的患者是否为复发性肿瘤有关。
总之,HAL-PDD能够更加准确地检测膀胱肿瘤及精确地切除病灶,减少复发概率,但对于改善疾病进展或生存率的作用尚未被证实。正在开发的光敏剂如金丝桃素等,不易受到光漂白,且具有较高的敏感度和特异性,效果优于5-ALA和HAL[12, 13]。
2 窄带成像技术
窄带成像技术(narrow band imaging,NBI)是一种从白色光源中获得蓝光(415 nm)和绿光(540 nm)光谱的技术,两光谱具有不同的穿透黏膜能力,且优先被血红蛋白吸收,增强黏膜及黏膜下血管的显影。而肿瘤或CIS拥有较高密度的脉管系统,NBI通过暗绿色或棕色视觉图像来凸显蓝光和绿光[14]。NBI器械具有与软性、硬性膀胱镜检查组合的优点,在WLC和NBI之间实现快速实时评估。
NBI对膀胱肿瘤的诊断具有很高的准确性,尤其是对CIS的检测。一项427例患者临床研究发现NBI对膀胱肿瘤检出率优于WLC,两者敏感度分别为100%和83%(P=0.01),同时也可改善无复发生存期[15]。另一项荟萃分析显示[16],NBI和WLC对膀胱肿瘤的敏感度分别为94%(95%CI: 91~96)和85%(95%CI: 80~89);特异性分别为85%(95%CI: 81~88)和87%(95%CI: 83~90),假阳性率为32%~36%,常与卡介苗治疗和炎性病症有关[14, 17]。此外,一项联合NBI和WLC诊断膀胱肿瘤的回顾性分析显示[18],NBI、WLC检出率分别为98%和89%(P=0.002),179例患者中124例具有一致的诊断结果,16例尿路上皮癌由NBI单独检出,而仅3例尿路上皮癌由WLC单独检出。
3 光学相干断层扫描
光学相干断层扫描(optical coherence tomography,OCT)是一种允许实时“光学活检”的技术,利用近红外光束(890~1300 nm)探测组织不同层面的反射特性,提供一幅高分辨率的横断层面图像,穿透深度1~2 mm。该装置易与标准膀胱镜检查结合,且学习曲线相对较短。
OCT能够准确区分良、恶性膀胱组织。Manyak发现在24例患者中区别良性和恶性肿瘤损伤的敏感度和特异性分别为100%和89%;其中Ta期肿瘤敏感度和特异性分别为90%和89%[19];然而,膀胱良性病变如炎性反应、黏膜侵蚀及肉芽肿等可造成假阳性结果。OCT也可与FC结合提高FC的诊断膀胱肿瘤的特异性[20],Schmidbauer等在68例患者中发现可将特异性从62.5%提高到87.5% [21]。
目前,OCT能够非常准确的区分和识别非侵袭性肿瘤(Ta)和侵袭性肿瘤(T1-T3),这可能有助于术者判断是否切除固有肌层以及优化临床分期和病理分级[22]。
OCT技术创新主要在微探头及三维(3-D)成像方面。微探头可以进一步评估上尿路的情况,与手提电脑的结合增加了可移动的特点,更方便于门诊患者的诊断;3-D OCT系统可准确诊断多变的CIS形态[23, 24]。未来新技术可能会应用于在临床工作。
4 共聚焦激光显微内镜
共聚焦激光显微内镜(confocal laser endomicroscopy,CLE)是一种允许即时“光学活检”的高端内镜。该技术利用488 nm激光及荧光对比剂,允许对表面结构实时原位、深入细胞水平的组织学图像,避免了不必要的活检,但穿透深度的不足尚不能有效评价固有肌层的情况。现该技术已成熟运用于消化道疾病的诊断[25, 26, 27]。
CLE拥有可通过膀胱镜钳道的微探头,选择可疑膀胱组织宏观成像,提供诊断依据。Sonn等首先提出该技术不仅能够区分良性和恶性组织,而且还可识别低级别和高级别肿瘤[28]。一项研究显示对于WLC与CLE联合准确诊断膀胱癌的敏感度和特异性分别为89%和88%,且初学者使用CLE诊断膀胱癌的准确性类似于单独使用WLC[29]。另一项试验研究中,Bonnal等[30]发现PDD和CLE组诊断膀胱肿瘤的可行性,未来可能会有助于提高PDD的特异性。
5 其他技术创新
拉曼光谱(Raman spectroscopy)是另一种备受关注的显微内镜技术。Draga等首次报告拉曼光谱运用于患者体内诊断膀胱肿瘤,敏感度、特异性分别为85%和79%[31]。最近研究中,Barman等通过改进探头采样的深度,发现在14位患者的28个样本中诊断膀胱肿瘤的灵敏度、特异性分别为86%和100%[32]。
虚拟膀胱镜检查(virtual cystoscopy,VC)对膀胱肿瘤的诊断目前仍处于试验阶段,而已证明对肠道病灶诊断具有高度精确的特征[33]。Karabacak等报告了VC可检测的最小病变面积为0.2 cm×0.3 cm[34],这与Kalokairinou等研究结果相似[35]。
空气膀胱镜检查(air cystoscopy)在诊断膀胱癌引起活动性出血上具有较高的敏感度和特异性。如Ciudin等[36]发现吹入空气与灌注水相比,在活动性出血下诊断膀胱癌的敏感度分别为88%和47%(P=0.003),特异性分别为97%和100%(P=0.93)。
目前,其他先进的成像技术也正在快速发展,以协助诊断及治疗膀胱癌,如光声成像技术[37]、双光子激光显微镜技术[38]等。
6 结论
正确评估膀胱癌的分期和分级是确定个体化治疗方案的前提。WLC、FC与高清晰成像技术、3D技术相结合并取得了长足的进展,为上、下尿路提供了最佳内窥镜影像。新型内镜成像技术的应用为提高肿瘤检测率及改善临床分期提供了机会,从而改善个体化治疗的方案;也提供了实时评价组织微结构的功能,使显微镜直接行膀胱内检查,避免了不必要的活检。泌尿外科医生应熟悉这些工具并支持其临床试验,确信未来新兴技术将使更多患者受益。
Competing interests: The authors declare that they have no competing interests.作者贡献:柯少波:思路设计,数据整理,论文撰写汪晶、邱虎、蔡高科、龚毅:病例搜集,数据整理陈永顺:参与选题及设计,提出建议、指导论文 -
表 1 35例晚期肝癌患者的基线特征
Table 1 Baseline characteristics of 35 patients with advanced liver cancer

-
[1] 陈万青, 李贺, 孙可欣, 等. 2014年中国恶性肿瘤发病和死亡分析[J]. 中华肿瘤杂志, 2018, 40(1): 5-13. https://www.cnki.com.cn/Article/CJFDTOTAL-ZHLU201801001.htm Chen WQ, Li H, Sun KX, et al. Report of Cancer Incidence and Mortality in China, 2014[J]. Zhonghua Zhong Liu Za Zhi, 2018, 40(1): 5-13. https://www.cnki.com.cn/Article/CJFDTOTAL-ZHLU201801001.htm
[2] Shui Y, Yu W, Ren X, et al. Stereotactic body radiotherapy based treatment for hepatocellular carcinoma with extensive portal vein tumor thrombosis[J]. Radiat Oncol, 2018, 13(1): 188. doi: 10.1186/s13014-018-1136-5
[3] Saeed A, Hildebrand H, Park R, et al. Immune Checkpoint Inhibitors versus VEGF Targeted Therapy as Second Line Regimen in Advanced Hepatocellular Carcinoma (HCC): A Retrospective Study[J]. J Clin Med, 2020, 9(9): 2682-2691. doi: 10.3390/jcm9092682
[4] Wilhelm S, Chien DS. BAY 43-9006: preclinical data[J]. Curr Pharm Des, 2002, 8(25): 2255-2257. doi: 10.2174/1381612023393026
[5] Wilhelm SM, Carter C, Tang L, et al. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis[J]. Cancer Res, 2004, 64(19): 7099-7109. doi: 10.1158/0008-5472.CAN-04-1443
[6] Kane RC, Farrell AT, Madabushi R, et al. Sorafenib for the treatment of unresectable hepatocellular carcinoma[J]. Oncologist, 2009, 14(1): 95-100. doi: 10.1634/theoncologist.2008-0185
[7] Ogasawara S, Ooka Y, Itokawa N, et al. Sequential therapy with sorafenib and regorafenib for advanced hepatocellular carcinoma: a multicenter retrospective study in Japan[J]. Invest New Drugs, 2020, 38(1): 172-180. doi: 10.1007/s10637-019-00801-8
[8] Ruan H, Dong J, Zhou X, et al. Multicenter phase Ⅱ study of apatinib treatment for metastatic gastric cancer after failure of second-line chemotherapy[J]. Oncotarget, 2017, 8(61): 104552-104559. doi: 10.18632/oncotarget.21053
[9] 王静, 贾敬好, 刘晶晶, 等. 阿帕替尼治疗晚期难治性乳腺癌的临床疗效观察[J]. 肿瘤防治研究, 2020, 47(11): 861-865. doi: 10.3971/j.issn.1000-8578.2020.19.1305 Wang J, Jia JH, Liu JJ, et al. Clinical Observation of Apatinib in Treatment of Refractory Advanced Breast Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(11): 861-865. doi: 10.3971/j.issn.1000-8578.2020.19.1305
[10] Liang Q, Kong L, Du Y, et al. Antitumorigenic and antiangiogenic efficacy of apatinib in liver cancer evaluated by multimodality molecular imaging[J]. Exp Mol Med, 2019, 51(7): 1-11.
[11] 姜增凯, 叶晓歌, 陈琴华. 阿帕替尼对肝癌细胞增殖和迁移能力的影响研究[J]. 中国临床药理学杂志, 2016, 32(15): 1422-1424. https://www.cnki.com.cn/Article/CJFDTOTAL-GLYZ201615023.htm Jiang ZK, Ye XG, Chen QH. Effect of apatinib on the proliferation and migration of liver cancer cells[J]. Zhongguo Lin Chuang Yao Li Xue Za Zhi, 2016, 32(15): 1422-1424. https://www.cnki.com.cn/Article/CJFDTOTAL-GLYZ201615023.htm
[12] Qiu J, Zhou Q, Zhang Y, et al. Discovery of novel quinazolinone derivatives as potential anti-HBV and anti-HCC agents[J]. Eur J Med Chem, 2020, 205: 112581. doi: 10.1016/j.ejmech.2020.112581
[13] 宋锦添, 陈奕贵, 许春伟, 等. 阿帕替尼治疗53例晚期原发性肝癌的疗效[J]. 临床与病理杂志, 2017, 37(3): 557-563. https://www.cnki.com.cn/Article/CJFDTOTAL-WYSB201703019.htm Song JT, Chen YG, Xu CW, et al. Effect of apatinib on treatment of 53 cases of advanced primary liver cancer[J]. Lin Chuang Yu Bing Li Za Zhi, 2017, 37(3): 557-563. https://www.cnki.com.cn/Article/CJFDTOTAL-WYSB201703019.htm
[14] 陶云霞, 李泳澄, 王翔, 等. 低剂量甲磺酸阿帕替尼治疗晚期原发性肝癌疗效与安全性[J]. 中华肿瘤防治杂志, 2020, 27(2): 141-145. https://www.cnki.com.cn/Article/CJFDTOTAL-QLZL202002012.htm Tao YX, Li YC, Wang X, et al. Efficacy and safety of low-dose apatinib treatment for advanced primary liver cancer[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2020, 27(2): 141-145. https://www.cnki.com.cn/Article/CJFDTOTAL-QLZL202002012.htm
[15] Lu W, Jin XL, Yang C, et al. Comparison of efficacy between TACE combined with apatinib and TACE alone in the treatment of intermediate and advanced hepatocellular carcinoma: A single-center randomized controlled trial[J]. Cancer Biol Ther, 2017, 18(6): 433-438. doi: 10.1080/15384047.2017.1323589
[16] Liu S, Wu F, Zhang Y, et al. Apatinib Combined With Radiotherapy Enhances Antitumor Effects in an In Vivo Nasopharyngeal Carcinoma Model[J]. Cancer Control, 2020, 27(1): 1073274820922553. http://www.researchgate.net/publication/341469191_Apatinib_Combined_With_Radiotherapy_Enhances_Antitumor_Effects_in_an_In_Vivo_Nasopharyngeal_Carcinoma_Model
[17] Zhen L, Jiali C, Yong F, et al. The Efficacy and Safety of Apatinib Treatment for Patients with Unresectable or Relapsed Liver Cancer: a retrospective study[J]. J Cancer, 2018, 9(16): 2773-2777. doi: 10.7150/jca.26376
[18] 朱振华, 褚行琦. 阿帕替尼治疗老年晚期肝癌的临床效果及安全性[J]. 中华老年多器官疾病杂志, 2020, 19(5): 360-363. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLQG202005012.htm Zhu ZH, Zhu XQ. Efficacy and safety of apatinib in treatment of elderly patients with advanced hepatocellular cancer[J]. Zhonghua Lao Nian Duo Qi Guan Ji Bing Za Zhi, 2020, 19(5): 360-363. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLQG202005012.htm
[19] Eugen K. Current treatment options for hepatocellular carcinoma[J]. Klin Onkol, 2020, 33(Supplementum 3): 20-25. http://www.researchgate.net/publication/347582415_Current_treatment_options_for_hepatocellular_carcinoma



 下载:
下载: